HOLIPANC
Offene, einarmige Phase II klinische Studie zur Wirksamkeit, Sicherheit und Lebensqualität einer neoadjuvanten Chemotherapie aus liposomalem Irinotecan kombiniert mit Oxaliplatin und 5-Fluorouracil/Folinsäure (NAPOX), gefolgt von kurativer Resektion bei Patienten mit auf die Leber beschränktem oligometastatischen Adenokarzinom des Pankreas (HOLIPANC)
Registrierung: NCT04617457
Studiengruppe:
Sponsor: Universität zu Köln
Studienleiter in Freiburg: Dr. Sophia Chikhladze, Stellvertreter: Prof. Dr. Heiko Becker
Erwartetes Ergebnis/Studienziel
Bei liposomalem Irinotecan handelt es sich um eine neue Formulierung (pharmazeutische Zubereitung) der Substanz Irinotecan, die länger im Blutstrom bleibt und höhere intratumorale Konzentrationen von Irinotecan sowie von dessen aktiven Metaboliten SN-38 erzeugt. Mit NAPOX erhält der Patient eine verbesserten FOLFIRINOX-Variante.
Ziele
- Bewertung der Wirksamkeit der neoadjuvanten NAPOX-Chemotherapie mit anschließender R0/R1-Resektion in Patienten mit auf die Leber beschränktem, oligometastatischen Adenokarzinom des Pankreas (≤ 5 Metastasen)
- Bewertung der Sicherheit des Behandlungskonzepts
- Vergleich der gesundheitsbezogenen Lebensqualität mit Gesamtüberleben nach R0/R1 Resektion
Wer kann teilnehmen?
Patienten mit histologisch bestätigter Diagnose eines unbehandelten Adenokarzinoms der Bauchspeicheldrüse mit limitierter Lebermetastasierung.
Definition einer limitierten Lebermetastasierung: 1 bis 5 Metastasen in CT/MRT- oder kontrastverstärktem Ultraschall-Scan, die potentiell resezierbar oder mit ablativen Verfahren behandelbar sind.
Studiendurchführung:
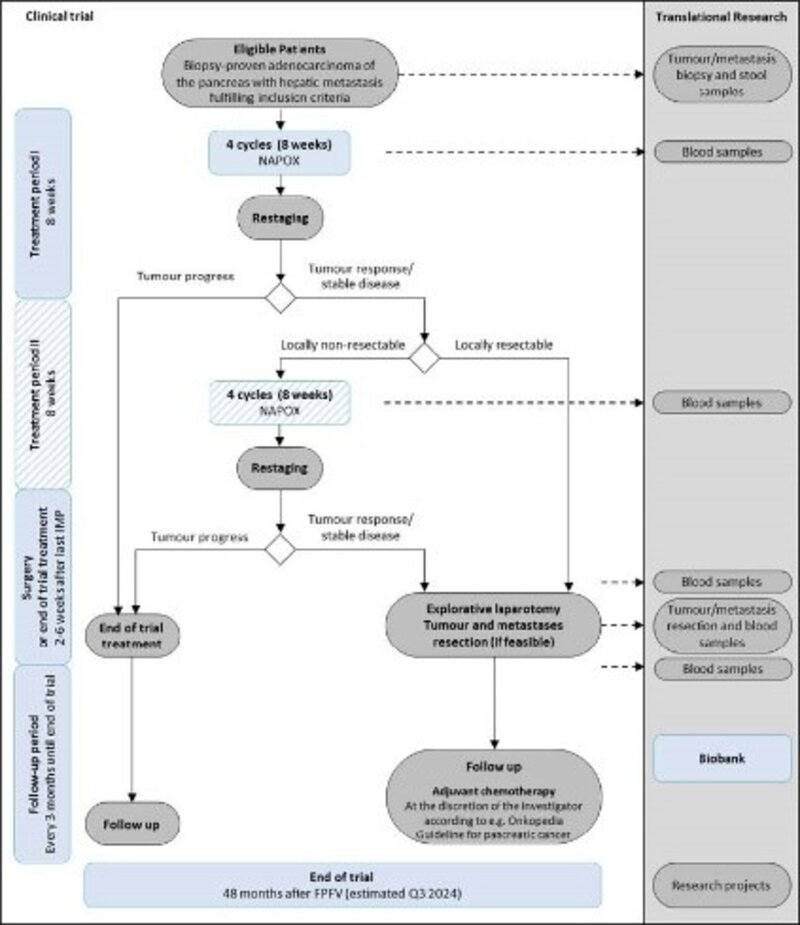
Im Rahmen der HOLIPANC-Studie wird liposomales Irinotecan (nal-IRI/Onivyde) als Studienmedikation mit Oxaliplatin, 5-Fluouracil und Folinsäure (NAPOX) in Zyklen von 14 Tagen appliziert.
Alle Patienten, die insgesamt 8 Zyklen erhalten und anschließend eine Tumorreaktion oder eine Stabilisierung der Erkrankung gemäß RECIST v1.1 aufweisen, werden 2-6 Wochen nach der letzten Behandlung mit dem Prüfpräparat (IMP) einer explorativen Laparotomie unterzogen. Wenn nach Ansicht des Chirurgen eine Resektion durchführbar ist, werden synchron der Primärtumor und die Lebermetastasen reseziert werden.
Status: Rekrutierung läuft
METAPANC
Intensivierte Behandlung bei Patienten mit oligometastasiertem Bauchspeicheldrüsenkrebs: Multimodale chirurgische Behandlung gegenüber alleiniger systemischer Chemotherapie:
eine randomisierte kontrollierte Phase III Studie (FOMA-ID: 2020-01069)
Registrierung: EUCT number:2023-503558-10-00
Studiengruppe
Sponsor: Universität Göttingen
Studienleiter in Freiburg: Dr. Sophie Chikhladze, Stellvertreter: Prof. Dr. Heiko Becker
Erwartetes Ergebnis/Studienziel
In der Metapanc-Studie wird untersucht, ob die Überlebensrate sowie die Lebensqualität bei Patienten mit oligometastatischem Bauchspeicheldrüsenkrebs bei Behandlung mit perioperativem mFOLFIRINOX und anschließender kompletter chirurgischer Resektion besser ist als bei einer alleinigen mFOLFIRINOX-Chemotherapie in der Erstlinienbehandlung. mFOLFIRINOX, ist ein modifiziertes FOLFIRINOX-Schemas (Fluorouracil, Leucovorin, Irinotecan und Oxaliplatin), bei welchem auf die zusätzliche Fluorouracil-Bolusgabe verzichtet wird, um die hämatologische Toxizität sowie gastrointestinale Nebenwirkungen zu mildern.
Wer kann teilnehmen?
An der Studie können nur Patienten/innen teilnehmen, bei denen nicht mehr als 3 Lebermetastasen nachweisbar sind und histologisch oder zytologisch ein Adenokarzinom des Pankreas bestätigt worden ist. Der Primärtumor sowie die Metastasen sind medizinisch und technisch operabel.
Studiendurchführung
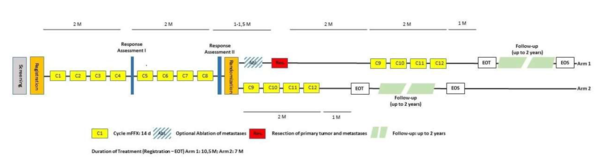
Die Studie gliedert sich in zwei Phasen:
- Die erste Phase ist für alle Teilnehmer/innen gleich: Behandlung mit der Standardtherapie mit zweimal vier Zyklen Chemotherapie im Abstand von 14 Tagen mit der Wirkstoffkombination mFOLFIRINOX (gelbe Kästchen im Ablaufschema).
- Die zweite Phase der Studie beginnt mit der zufälligen Zuweisung der Patienten/-innen zu einem von zwei unterschiedlichen Studienarmen im Verhältnis 1:1:
Im Studienarm 2 folgt der empfohlenen Standardtherapie mit 4 weiteren Zyklen mFOLFIRINOX ohne chirurgischen Eingriff. Im Studienarm 1 werden 4 bis 6 Wochen nach der vorhergehenden Chemotherapie der Tumor der Bauchspeicheldrüse reseziert sowie die Metastasen in der Leber chirurgisch oder ablativ entfernt. 2 Monate nach der Resektion erfolgen gemäß der Standardtherapie weitere vier Zyklen mFOLFIRINOX-Chemotherapie.
Status: Rekrutierung läuft
ESPAC6
Eine offene Phase-III-Studie zur Wirksamkeit einer Chemotherapie nach Operation beim duktalen Adenokarzinom der Bauchspeicheldrüse, wobei die Zuteilung zur Oxaliplatin-basierten oder Gemcitabin-basierten Chemotherapie entweder nach klinischen Standardkriterien oder nach genetischen Markern erfolgt.
Registrierung: NCT05314998
Studiengruppe:
Sponsor: Ruprecht-Karls-Universität Heidelberg
Studienleiter in Freiburg: PD Dr. Dietrich Ruess, Stellvertreter: Dr. Philipp Holzner
Erwartetes Ergebnis/Studienziel:
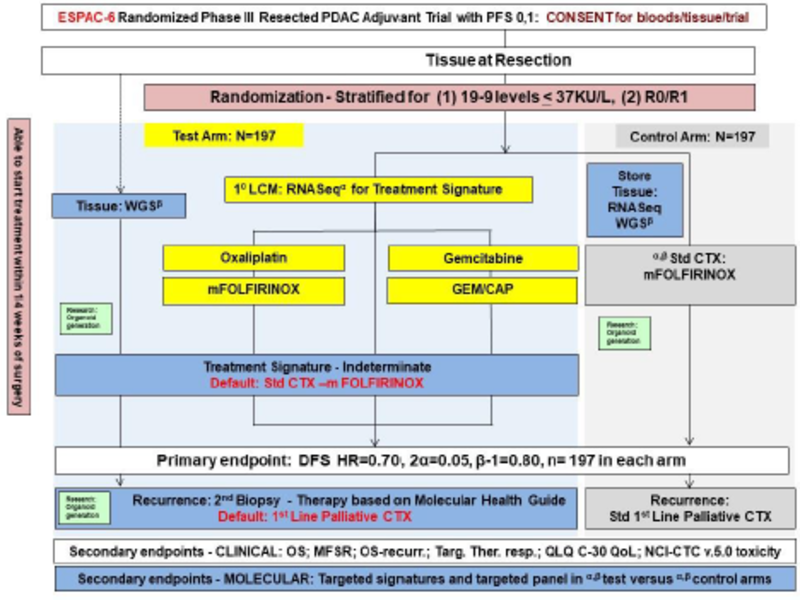
Das primäre Ziel der Studie ist die Untersuchung, ob das krankheitsfreie Überleben bei Patienten mit reseziertem duktalem Pankreas-Adenokarzinom (PDAC), die standardgemäß mit einem adjuvanten Chemotherapieschemata (mFOLFIRINOX: Oxaliplatin, Irinotecan, Folinsäure und 5-Fluorouracil oder Gemcitabin und Capecitabin) behandelt werden, bei einer Zuteilung auf der Grundlage einer behandlungsspezifischen Signatur (TSS ꓿ individuelles Profil genetischer Marker) besser ist, als bei denselben Chemotherapie-Schemata (auf Oxaliplatin- oder Gemcitabinbasis), die nach klinischen Kriterien zugeteilt werden.
Weitere Ziele der Studie sind die Bewertung des Gesamtüberlebens (mediane 3-Jahres-Überlebensrate), des Metastasen-freien Überlebens, des Überlebens auf der Grundlage gezielter Signaturen (TSS) in Test- und Kontrollgruppen sowie des Überlebens bei Verwendung gezielter Therapien bei Rückfall im Vergleich zu standardmäßigen Erstlinientherapien bei Rückfall.
Im Rahmen des optionalen translationalen Forschungsprogramms ESPAC-6 werden Tumorproben und Blutproben entnommen, um die individuellen genetischen Marker, die das Ansprechen auf eine Chemotherapie oder einen Rückfall vorhersagen können, zu identifizieren.
Wer kann teilnehmen?
Patienten, bei denen dem Standard entsprechend außerhalb der Studie bereits makroskopisch der Pankreastumor vollständig (R0- oder R1-Resektion) entfernt wurde und ein duktales Adenokarzinom einschließlich Varianten und Azinuszellkarzinom des Pankreas histologisch nachgewiesen wurde. Bei der Resektion muss Tumorgewebe für RNAseq bereitgestellt worden sein. Keine vorherige Strahlentherapie oder vorherige Chemotherapie gegen das Pankreaskarzinom ist erlaubt.
Studiendurchführung
Adjuvante chemotherapeutische Behandlung nach Randomisierung: entweder mFOLFIRINOX: 12 Zyklen, 2 wöchentlich oder 6 Zyklen Gemcitabin/Capecitabin, 4 wöchentlich:
Randomisierung zu folgenden Studienarmen:
Test-Behandlungsarm: Zuteilung einer Chemotherapie basierend auf genetischen Markern
Kontroll-Behandlungsarm: Zuteilung zur Chemotherapie nach klinischen Standardkriterien
Status: Rekrutierung: geplant für Q4 2024
RECOPS
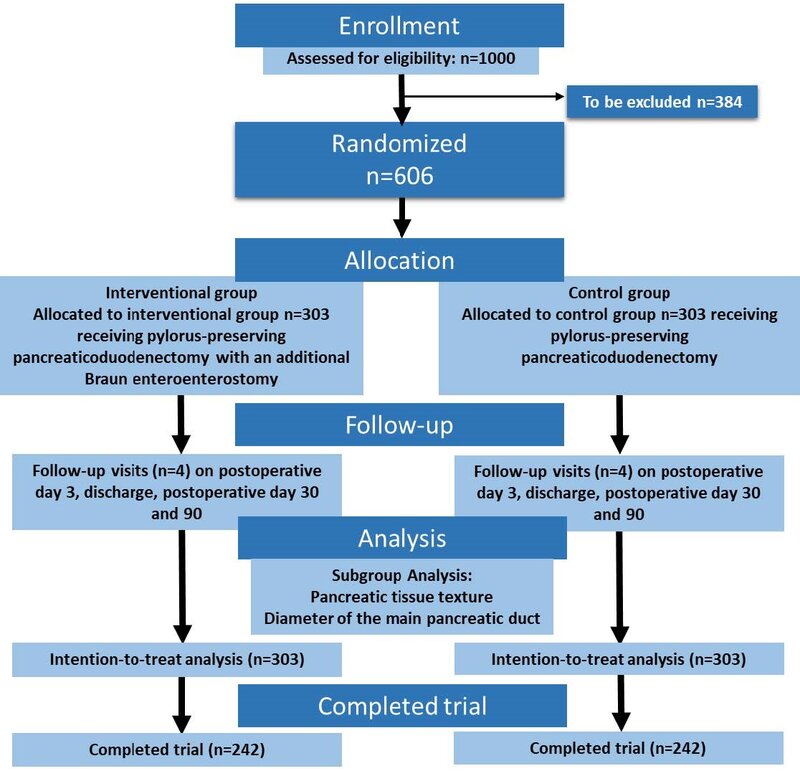
Der Einfluss der Braun- Fußpunktanastomose (Braun-Enteroenterostomie) auf das postoperative Ergebnis nach pyloruserhaltender Pankreaskopfresektion (Pankreatikoduodenektomie).
Registrierung: DRKS00024364
Studiengruppe:
Sponsor: Klinikum rechts der Isar der TU München
Studienleiter in Freiburg: PD Dr. Dietrich Ruess, Stellvertreterin: Dr. Sophia Chikhladze
Erwartetes Ergebnis/Studienziel:
Bei der pyloruserhaltenden, partiellen Pankreatoduodenektomie wurden für die Wiederherstellung der Magen-Darm-Passage bereits mehrere Rekonstruktionstechniken entwickelt. Eine davon ist die so genannte Rekonstruktion nach Child, die eine Nahtverbindung von Bauchspeicheldrüse, Gallengänge und Duodenum bei pyloruserhaltenden Operationen bzw. vom Magen bei der klassischen Variante an einer einzelnen Dünndarmschlinge vorsieht. Undichtigkeiten an der Nahtverbindung zwischen Dünndarmschlinge und Restbauchspeicheldrüse stellt das Hauptrisiko der postoperativen Sterblichkeit sowie für das Auftreten von postoperativen Komplikationen dar. Um die Rate an Undichtigkeiten zu vermindern, untersucht die hier vorgestellte Studie den Nutzen einer zusätzlichen Nahtverbindung zwischen zwei Dünndarmschlingen.
Studienziel:
In der hier vorgestellten Studie soll der Nutzten einer zusätzlichen Anastomose zwischen der afferenten und efferenten Schlinge bei der Duodenojejunostomie – auch Braun‘sche Fußpunktanastomose (BE-Child) genannt – erschlossen werden. Diese soll den Abfluss der Gallen- und Pankreasflüssigkeiten aus der zuführenden Schlinge erleichtern und gleichzeitig einen Reflux aus der abführenden Schlinge reduzieren, um somit die Pankreatikojejunostomie zu entlasten. Dadurch sollen nicht nur die Rate an Pankreasfisteln sondern auch die Rate an postoperativen Komplikationen per se reduziert werden.
Wer kann teilnehmen
Patienten mit gutartigen oder bösartigen Erkrankungen des Pankreas, des distalen Gallenganges und des Duodenums, die eine pyloruserhaltende Pankreatikoduodenektomie benötigen.
Studiendurchführung
Diese klinische Studie ist als multizentrische, randomisierte, kontrollierte, beobachterblinde Studie mit zwei Studienarmen konzipiert:
Gruppe 1: Patienten mit pyloruserhaltender Pankreatikoduodenektomie und Standard-Child-Rekonstruktion (S-Child) (Abb. 1a)
Gruppe 2: Patienten mit pyloruserhaltender Pankreatikoduodenektomie und Child-Rekonstruktion mit Braun-Enteroenterostomie (BE-Child)
Status: Rekrutierung läuft
TRIANGLE
Konventionelle partielle Pankreatoduodenektomie versus erweiterte Pankreatoduodenektomie (TRIANGLE Operation) bei Pankreaskopfkarzinom - randomisiert kontrollierte TRIANGLE-Studie.
Registrierung: DRKS00030576
Studiengruppe:
Sponsor: Universitätsklinikum Tübingen
Studienleiter in Freiburg: PD Dr. Dietrich Ruess, Stellvertreterin: Dr. Sophia Chikhladze
Erwartetes Ergebnis/Studienziel:
Die Operation des Pankreaskarzinoms stellt die einzige potenziell kurative Behandlung dar und führt auch bei Patientinnen und Patienten mit einem grenzwertig operablen oder lokal fortgeschrittenen Tumor zu einer signifikant besseren Prognose als die alleinige Chemotherapie. Einer der Hauptgründe für ein erneutes Auftreten der Erkrankung ist ein Lokalrezidiv, wobei sich die meisten Lokalrezidive im Bereich des Weichgewebes entlang des Truncus coeliacus und der Arteria mesenterica superior finden.
Die multizentrische TRIANGLE-Studie untersucht, ob eine partielle Pankreatoduodenektomie (PD) mit erweiterter Dissektion entlang der Ateria mesenterica superior (AMS) und Entfernung des gesamten lymphatischen und perineuralen Gewebes im so genannten ‚Dreieck‘ zwischen Arteria mesenterica superior, Pfortader und Truncus coeliacus d. h. der sogenannten TRIANGLE-Region bei einem Pankreaskopfkarzinom, das krankheitsfreie Überleben im Vergleich zur aktuellen Standardoperation "Whipple´sche Operation" (partielle Pankreatoduodenektomie mit Entfernung des Pankreaskopfes, des Duodenums, des distalen Gallengangs, der Gallenblase und ggf. eines Teils des Magens) verbessern kann.
Der mögliche Vorteil steht den potenziellen Risiken gegenüber, zum Beispiel starke Durchfälle oder vermehrte Blutungen und postoperative Komplikationen. Die geplante Studie soll eine objektive Risiko-Nutzen-Bewertung der radikaleren Operation ermöglichen.
Studiendurchführung: Multizentrische, randomisierte und kontrollierte TRIANGLE-Studie:
Arm 1: Experimentell: TRIANGLE - Operation: Partielle Pankreatoduodenektomie mit
- radikaler Weichteildissektion entlang der Arteria mesenterica superior (Level 3 nach Inoue et al.) um mindestens 180 Grad (5 bis 11 Uhr) UND
- vollständige Dissektion der Weichteile zwischen Truncus Coeliacus, Arteria mesenterica superior und der mesenterico-portalen Achse
Arm 2: Kontrollintervention (Standard-Whipple):
- Standard-Dissektion der Arteria mesenterica superior (Inoue Level 1 oder 2)
- Standard-Lymphadenektomie entsprechend S3-Leitlinie
Wer kann teilnehmen?
Patienten mit Verdacht auf ein resektables, Borderline oder lokal fortgeschrittenes Pankreaskopfkarzinom (d. h. duktales Adenokarzinom des Pankreas, IPMN-Karzinom (intraduktale papilläre muzinöse Neoplasien) oder periampulläres Karzinom vom pankreatobiliären Typ) und Patienten, bei denen eine elektive partielle Pankreatoduodenektomie geplant ist (unabhängig von einer neoadjuvanten Therapie)
Status: Rekrutierung geplant: Q4 2024
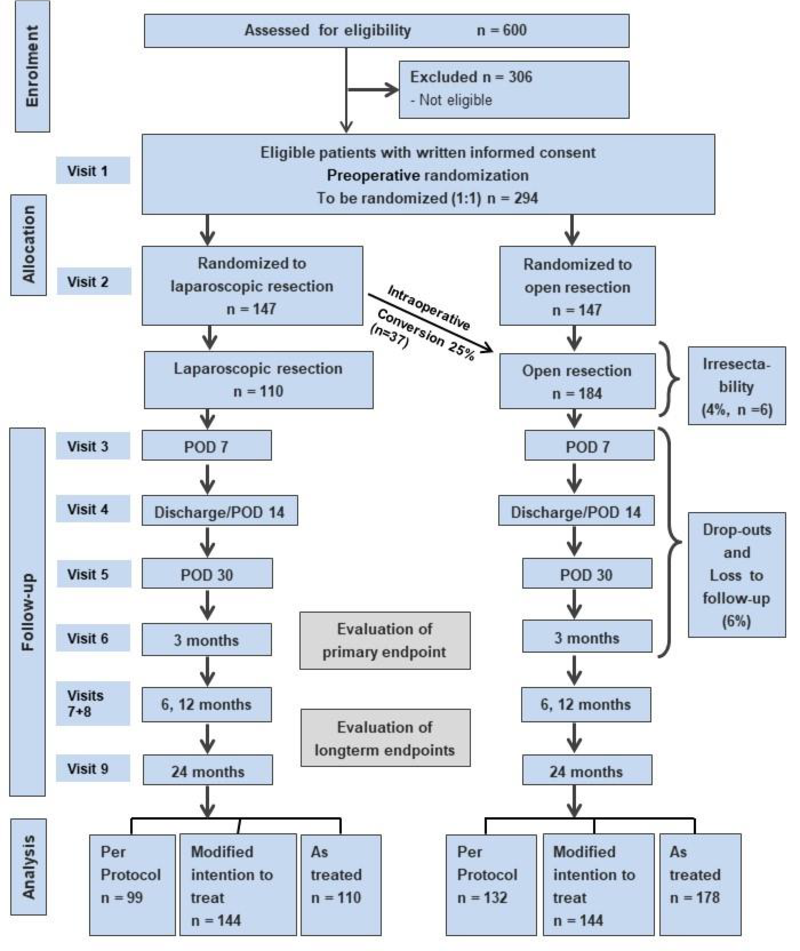
DISPACT 2
DISPACT-2 – Distale Pankreatektomie – eine randomisiert kontrollierte Studie zum Vergleich der minimal invasiven mit der offenen Resektion
Registrierung: DRKS00014011
Studiengruppe
Sponsor: Ruprecht-Karls-Universität Heidelberg
Studienleiter in Freiburg: PD Dr. Dietrich Ruess
Erwartetes Ergebnis/Studienziel
Kurzbeschreibung: Der Behandlungserfolg einer Operation ist nicht nur abhängig von der Erkrankung, sondern auch vom Schaden des chirurgischen Zugangs. Die minimal invasive Operation vermindert postoperative Schmerzen und führt zu verbesserter Mobilität, weniger pulmonalen Infekten und schnellerer Erholung und einer besseren Lebensqualität.
Ziel der DISPACT 2-Studie ist, dass die minimal invasive Pankreatektomie bezüglich postoperativer Komplikationen, klinischer und onkologischer Wirksamkeit, Sicherheit, Lebensqualität und Kosten der offenen Resektion des Pankreas nicht unterlegen ist. Der minimal invasive Ansatz mit seiner geringeren Invasivität verspricht eine Verringerung der postoperativen Schmerzen und anschließend eine bessere Mobilisierung der Patienten und weniger Komplikationen der Atemwege, was zu einer schnelleren Genesung und kürzeren Krankenhausaufenthalten führt.
Im Falle von gleich vielen postoperativen Komplikationen und gegebener onkologischer Sicherheit und bei gleichzeitig verbesserter Lebensqualität sollte die minimal invasive Resektion den Patienten als erste Wahl angeboten werden.
Studiendurchführung
Multizentrische, randomisierte und kontrollierte Studie:
Arm 1: Minimal invasive distale Pankreasresektion
Arm 2: Offene distale Pankreasresektion
Wer kann teilnehmen ?
Patienten mit einer geplanten distalen Pankreatektomie mit oder ohne Splenektomie für jegliche Indikation ohne Fernmetastasen oder Tumorinfiltration der V. mesenterica superior, A. mesenterica superior oder A. hepatica.
Status: Rekrutierung läuft
Frau Dr. rer. nat. Andrea Klock
9761 270 28080
andrea.klock@uniklinik-freiburg.de
Herr Henri Hansen
0761 270 90780
henri.hansen@uniklinik-freiburg.de
0761 270 90781