Unser Know-how
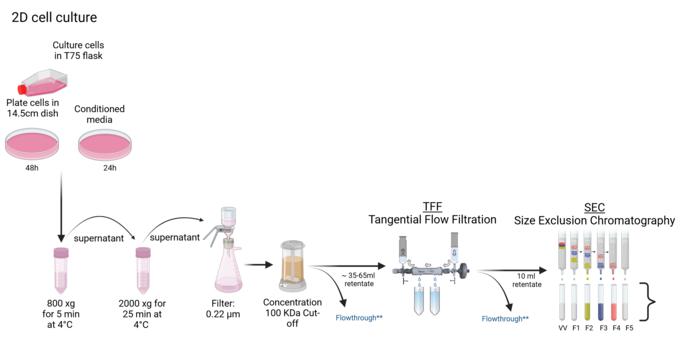
Wir sind spezialisiert auf die Isolierung extrazellulärer Vesikel (EV) aus verschiedenen Proben, darunter Zellkulturen, Organoide, Bakterien und Körperflüssigkeiten. Unser Ansatz nutzt fortschrittliche Tangentialflussfiltrationstechniken (TFF) mit dem TFF Easy-Gerät, ergänzt durch Größenausschlusschromatographie (SEC). Mit dieser Methodik erhalten wir EV von höchster Reinheit und Integrität, die sich für nachfolgende analytische Zwecke oder die Charakterisierung mit einer Reihe von biochemischen und molekularbiologischen Techniken eignen.
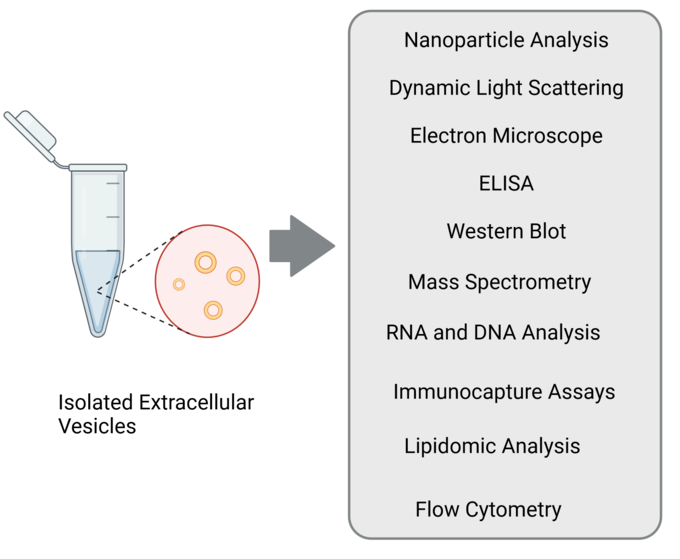
Die Charakterisierung von EVs kann ein komplexer Prozess sein, und wir verwenden oft eine Kombination der folgenden Techniken, um ein umfassendes Verständnis ihrer Eigenschaften und Funktionen zu erhalten.
Größe und Konzentrationsanalyse
1. Analyse einzelner Vesikel
Dynamic Light Scattering (DLS): DLS misst die Größenverteilung von EVs, indem es analysiert, wie sie Licht streuen, während sie sich in einer Flüssigkeit bewegen. Sie liefert Informationen über die Größenverteilung von Vesikeln.
Nanoparticle Tracking Analysis (NTA): NTA verfolgt einzelne EVs durch Analyse der Brownschen Bewegung. Sie liefert Informationen über die Größenverteilung und Konzentration in bestimmten Größenbereichen.
Flow NanoAnalyzer, nano-Durchflusszytometer (nanoFCM): NanoFCM ermöglicht uns eine Multiparameteranalyse, bei der wir gleichzeitig die Partikelkonzentration, die Größenverteilung und die biochemischen Eigenschaften einzelner EVs messen. Dieser Detaillierungsgrad ist entscheidend, insbesondere bei der Untersuchung komplexer und heterogener Populationen von Nanopartikeln wie kleinen EVs.
2. Fluoreszenztechniken für die Analyse von Vesikeln
Färbung mit Fluorophoren und Markierung von Membranen mit Farbstoffen: Wir verwenden Membranfarbstoffe, die selektiv EV-Membranen markieren, und Fluoreszenzfarbstoffe, die spezifisch an die in den EVs vorhandenen Nukleinsäuren (RNA/DNA) binden.
Fluoreszenzanalyse: Nach der Markierung der EVs mit Membranfarbstoffen und der Färbung mit Fluorophoren zur Konzentrationsmessung analysieren wir die Proben mit einem Durchflusszytometer oder einem Fluoreszenzmikroskop. Die Fluoreszenzmikroskopie ermöglicht den Nachweis einzelner EVs in Echtzeit und die Verfolgung ihrer Interaktion und Aufnahme in lebende Zellen.
Morphologie
Transmissionselektronenmikroskopie (TEM): Die TEM ermöglicht die direkte Visualisierung von EVs mit einer Auflösung im Nanobereich und liefert Informationen über ihre Form und Morphologie. Wir arbeiten zusammen mit der Core Facility für Elektronenmikroskopie (EMcore) am Universitätsklinikum Freiburg, die unter der Leitung von Dr. Martin Helmstädter modernste TEM-Dienstleistungen für eine umfassende Analyse von EVs bietet.
Protein Zusammensetzung
1. Analyse von EV Proteinen
Bead-assisted Durchflusszytometrie: Sie wird zum Nachweis von Oberflächenproteinen auf EV mit fluoreszenzmarkierten Antikörpern, die spezifisch für die Oberflächenproteine von EVs sind, benutzt.
Immunocytochemistry/Immunofluoreszenz: Es umfasst die Markierung von EVs mit fluoreszierend markierten Antikörpern, die für die interessierenden Oberflächenproteine spezifisch sind.
Multiplex protein profiling assays: Sie werden für den Nachweis von Oberflächenproteinen auf EVs eingesetzt und ermöglichen den gleichzeitigen Nachweis und die Quantifizierung mehrerer Proteine in einer einzelner Probe, was einen umfassenden Ansatz zur Untersuchung der Proteinzusammensetzung von EVs bietet.
Enzyme-linked immunosorbent assay (ELISA): ELISA kann zum Nachweis von Oberflächenproteinen auf EVs angepasst werden, indem EVs auf einer Festphasenoberfläche, z. B. einer Mikroplattenvertiefung, immobilisiert und mit – für die Zieloberflächenproteine spezifischen – Antikörpern, untersucht werden. Die gebundenen Antikörper werden dann mit Enzym-konjugierten sekundären Antikörpern und einem chromogenen oder chemilumineszenten Substrat nachgewiesen.
Meso Scale Discovery (MSD) assays - Multiplex Assay Kits: Wir verwenden Durchflusszytometrie-Kits für menschliche EV, mit denen bis zu 37 EV-Marker und 2 Kontrollen nachgewiesen werden können.
2. Ganzheitliche Proteinanalyse
Western Blot (WB): WB wird zum Nachweis spezifischer Proteine auf der Oberfläche oder innerhalb von EVs verwendet und hilft, deren Ursprung und Transportgut zu identifizieren.
Massenspektrometrie (MS): Mit Hilfe der Massenspektrometrie kann die Proteinzusammensetzung von EVs im Hochdurchsatzverfahren analysiert werden, was detaillierte Informationen über ihre Transportgut liefert. Wir arbeiten zusammen mit der Proteomik Plattform – Core Facility (ProtCF) am Universitätsklinikum Freiburg.
Protein arrays (Sciomics GmbH) werden zur Charakterisierung der Oberflächenproteine und des Zytokingehalts von EVs verwendet.
Enzyme-linked immunosorbent assay (ELISA): ELISA erfasst, erkennt, charakterisiert und quantifiziert EVs/Exosomen in menschlichen Körperflüssigkeiten und Zellkulturüberständen.
Lipid-Zusammensetzung
Lipidomics: Mit Hilfe der Lipidomanalyse können die in EV-Membranen vorhandenen Lipidspezies identifiziert und quantifiziert werden, was Einblicke in ihre Lipidzusammensetzung ermöglicht.
Nukleinsäure-Analyse
RNA und DNA Analyse: Techniken wie RT-qPCR und Next Generation RNA-Sequenzierung werden eingesetzt, um den RNA- und DNA-Gehalt von EVs, einschließlich microRNAs und anderer nicht-kodierender RNAs, zu analysieren.
Funktionelle Assays
Uptake-Studien: Die Aufnahme von EVs durch Zielzellen wird mit Techniken wie der konfokalen Mikroskopie untersucht, die Einblicke in ihre funktionelle Rolle bei der interzellulären Kommunikation geben können.

Group Leader
Prof. Dr. rer. nat. Irina Nazarenko
+49 (0) 761 270 82100
irina.nazarenko@uniklinik-freiburg.de
Institute for Infection Prevention and Control
Medical Center – University of Freiburg
Breisacher Straße 115 b, 79106 Freiburg im Breisgau, Germany
X (formerly Twitter): @nazarenkoteam
LinkedIn: Extracellular vesicles research group - Prof. Irina Nazarenko
Instagram: @nazarenkoteam
Assistance
Susanne Görner
Phone: +49 (0) 761 270 82390
Fax: +49 (0) 761 270 82030
susanne.goerner@uniklinik-freiburg.de