Abteilung für Tumorimmunologie und Immunregulation
Die Anwendung von Immuntherapien hat die Behandlung von soliden Tumoren und hämatologischen Neoplasien in den letzten Jahren revolutioniert. Durch die allogene hämatopoetische Stammzelltransplantation wurde es möglich Patienten mit Hochrisiko Leukämien zu heilen, die ohne diese Option unheilbar gewesen wären.
Der Einsatz von Antikörpern gegen negative Regulatoren der T-Zell Aktivierung (sog. Checkpoint Inhibitoren) hat dazu geführt, dass Patienten mit metastasieren soliden Tumoren, die bis dahin als unheilbar galten, in einem Teil der Fälle geheilt werden konnten.
Um dieser wichtigen Entwicklung Rechnung zu tragen, ist es essenziell unseren Patienten eine Plattform für die immuntherapeutische Tumor-Behandlung und auch deren Nebenwirkungen zu bieten. In der Abteilung soll innovative präklinische Forschung mit der klinischen Prüfung von Immuntherapien z.T. auch erstmals am Menschen eingesetzter Medikamente in enger Zusammenarbeit mit der Early Clinical Trial Unit (ECTU) durchgeführt werden.
Ein wichtiger Aspekt wird dabei neben der Analyse der Wirksamkeit auch die bessere Beherrschung von Nebenwirkungen wie der Graft-versus-host (GVHD) Erkrankung nach allogener hämatopoetischer Stammzelltransplantation sowie von GVHD-ähnlichen Nebenwirkungen nach Immun-Checkpoint Inhibitor Behandlung sein.
Die Abteilung für Tumorimmunologie und Immunregulation bietet für die präklinischen und klinischen Arbeiten die strukturellen Voraussetzungen, sowie ein wissenschaftlich und klinisch geschultes Personal.
Team
Abteilungsleiter
Prof. Dr. med. Robert Zeiser
Sekretariat: Ines Giers
+49 (0) 761 270-33210
+49 (0) 761 270-96-36580

Dr. Justyna Rawluk
(Klinische Forschung,
Checkpoint Inhibitoren/solide Tumore)
Jun. Prof. Dr. Natalie Köhler
(CIBSS Juniorprofessur für Zielgerichtete Beeinflussung von Signalwegen)
Dr. Theresa Lowinus
Dr. Kristina Maas-Bauer
Dr. Tino Vollmer
Dr. Tobias Wertheimer
Was ist Tumorimmunologie?
Die Tumorimmunologie basiert auf der Theorie, dass das menschliche Immunsystem kontinuierlich im Körper patrouilliert, um Tumorzellen zu erkennen und abzutöten. Funktioniert dieser Vorgang nicht korrekt, wie beispielsweise wenn ein genetischer oder erworbener Immundefekt vorliegt, dann erhöht sich das Risiko an bestimmten Tumoren zu erkranken. Dieser Vorgang der "Immunüberwachung" wurde von Paul Ehrlich, sowie Lewis Thomas und Macfarlane Burnet postuliert.
Das Konzept, dass Veränderungen einer gesunden Zelle in Richtung einer Krebszelle vom Immunsystem erkannt werden kann und die Krebszellen aufgrund dieser Erkennung angegriffen werden können macht sich die Immuntherapie von Tumoren zunutze.
Einige Konzepte für die Tumor-Immuntherapie die den Eingang in die klinische Routine gefunden haben sind:
- Passive Immuntherapie
Beispiele: Monoklonale Antikörper gegen CD20, Bispezifische Antikörper - Blockade von Immun Escape-Mechanismen
Beispiele: CTLA-4/PD-1/PD-L1 Blockade - Aktive, spezifische Immuntherapie
Beispiel: allogene hämatopoetische Stammzelltransplantation
Checkpoint Inhibitoren sind zugelassen für die Behandlung des metastasierten Melanom, Nierenzellkarzinoms und Nichtkleinzelligen Bronchialkarzinoms.
==> Early Clinical Trial Unit (ECTU)
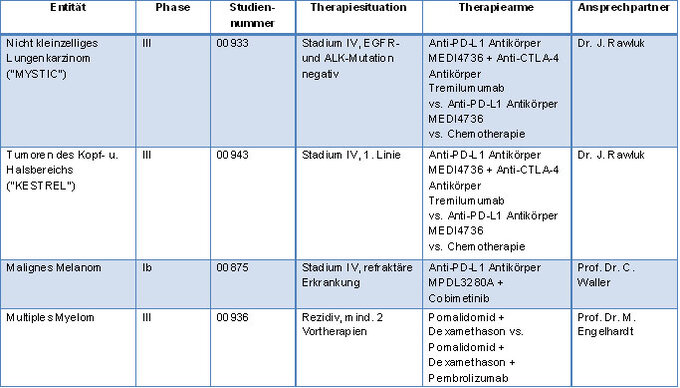
| Entität | Phase | Studien- Nr. | Therapie- situation | Therapie- arme | Ansprech- partner |
| Nicht-kleinzelliges Lungen- karzinom ("MYSTIC") | III | 00933 | Stadium IV, EGFR- und ALK- Mutation negativ | Anti-PD-L1 Antikörper MEDI4736 + Anti-CTLA-4 Antikörper Tremilumumab vs. Anti-PD-L1 Antikörper MEDI4736 vs. Chemo- therapie | Dr. J. Rawluk/ Dr. A. Krohn |
| Tumore des Kopf- u. Halsbereichs ("KESTREL") | III | Stadium IV, EGFR- und ALK-Mutation negativ | Anti-PD-L1 Antikörper MEDI4736 + Anti-CTLA-4 Antikörper Tremilumumab vs. Anti-PD-L1 Antikörper MEDI4736 vs. Chemotherapie | Dr. J. Rawluk | |
| Malignes Melanom | Ib | 00875 | Stadium IV, refraktäre Erkrankung | Anti-PD-L1 Antikörper MPDL3280A + Cobimetinib | Prof. Dr. C. Waller |
| Multiples Myelom) | III | 00936 | Rezidiv, mind. 2 Vortherapien | Pomalidomid + Dexamethason vs. Pomalidomid + Dexamethason + Pembrolizumab | Prof. Dr. M. Engelhardt |
- Die Rolle von "Danger associated molecular patterns" und neutrophiler Granulozyten bei Graft-versus-host Erkrankung
- Verbesserung des Graft-versus-Leukämie Effektes nach allogener hämatopoetischer Stammzelltransplantation
- Purinerge Rezeptoren und Adenosinphosphat Metabolismus bei GvHD und im Tumormicroenvironment
- Migration und Funktion von Zellpopulationen nach allogener hämatopoetischer Zelltransplantation
- Tumorzellmigration im Microenvironment, Extrazelluläre Matrix, Molekulare Bildgebung

Braun LM, Giesler S, Andrieux G, Riemer R, Talvard-Balland N, Duquesne S, Rückert T, Unger S, Kreutmair S, Zwick M, Follo M, Hartmann A, Osswald N, Melchinger W, Chapman S, Hutchinson JA, Haferkamp S, Torster L, Kött J, Gebhardt C, Hellwig D, Karantzelis N, Wallrabenstein T, Lowinus T, Yücel M, Brehm N, Rawluk J, Pfeifer D, Bronsert P, Rogg M, Mattern S, Heikenwälder M, Fusco S, Malek NP, Singer S, Schmitt-Graeff A, Ceteci F, Greten FR, Blazar BR, Boerries M, Köhler N, Duyster J, Ihorst G, Lassmann S, Keye P, Minguet S, Schadendorf D, Ugurel S, Rafei-Shamsabadi D, Thimme R, Hasselblatt P, Bengsch B, Schell C, Pearce EL, Meiss F, Becher B, Funke-Lorenz C, Placke JM, Apostolova P, Zeiser R. Adiponectin reduces immune checkpoint inhibitor-induced inflammation without blocking anti-tumor immunity.
Cancer Cell. 2025 Feb 10;43(2):269-291.e19. doi: 10.1016/j.ccell.2025.01.004.
Schmidt D, Endres C, Hoefflin R, Andrieux G, Zwick M, Karantzelis N, Staehle HF, Vinnakota JM, Duquesne S, Mozaffari Jovein M, Pfeifer D, Becker H, Blazar BR, Zähringer A, Duyster J, Brummer T, Boerries M, Baumeister J, Shoumariyeh K, Li J, Green AR, Heidel FH, Tirosh I, Pahl HL, Leimkühler N, Köhler N, de Toledo MAS, Koschmieder S, Zeiser R. Oncogenic Calreticulin Induces Immune Escape by Stimulating TGF-β Expression and Regulatory T Cell Expansion in the Bone Marrow Microenvironment.
Cancer Res. 2024 Jun 17. doi: 10.1158/0008-5472

Talvard-Balland N, Braun LM, Dixon KO, Zwick M, Engel H, Hartmann A, Duquesne S, Penter L, Andrieux G, Rindlisbacher LS, Acerbis A, Ehmann J, Köllerer C, Ansuinelli M, Rettig A, Moschallski K, Apostolova P, Brummer T, Illert AL, Schramm MA, Cheng Y, Köttgen A, Duyster J, Menssen HD, Ritz J, Blazar BR, Boerries M, Schmitt Graeff A, Sariipek N, van Galen P, Buescher JM, Cabezas-Wallscheid N, Pahl HL, Pearce EL, Soiffer RJ, Wu CJ, Vago L, Becher B, Köhler N, Wertheimer T, Kuchroo VK, Zeiser R. Oncogene induced TIM-3 ligand expression dictates susceptibility to anti-TIM-3 therapy in mice.
J Clin Invest. 2024 Jun 25:e177460. doi: 10.1172/JCI177460.
Vinnakota JM, Adams RC, Athanassopoulos D, Schmidt D, Biavasco F, Zähringer A, Erny D, Schwabenland M, Langenbach M, Wenger V, Salié H, Cook J, Mossad O, Andrieux G, Dersch R, Rauer S, Duquesne S, Monaco G, Wolf P, Blank T, Häne P, Greter M, Becher B, Henneke P, Pfeifer D, Blazar BR, Duyster J, Boerries M, Köhler N, Chhatbar CM, Bengsch B, Prinz M, Zeiser R. Anti-PD-1 cancer immunotherapy induces central nervous system immune-related adverse events by microglia activation.
Science Translational Medicine 2024 Jun 12;16(751):eadj9672. doi: 10.1126/scitranslmed.adj9672. Epub 2024 Jun 12. PMID: 38865481.
Vinnakota JM, Biavasco F, Schwabenland M, Chhatbar C, Adams RC, Erny D, Duquesne S, El Khawanky N, Schmidt D, Fetsch V, Zähringer A, Salié H, Athanassopoulos D, Braun LM, Javorniczky NR, Ho JNHG, Kierdorf K, Marks R, Wäsch R, Simonetta F, Andrieux G, Pfeifer D, Monaco G, Capitini C, Fry TJ, Blank T, Blazar BR, Wagner E, Theobald M, Sommer C, Stelljes M, Reicherts C, Jeibmann A, Schittenhelm J, Monoranu CM, Rosenwald A, Kortüm M, Rasche L, Einsele H, Meyer PT, Brumberg J, Völkl S, Mackensen A, Coras R, von Bergwelt-Baildon M, Albert NL, Bartos LM, Brendel M, Holzgreve A, Mack M, Boerries M, Mackall CL, Duyster J, Henneke P, Priller J, Köhler N, Strübing F, Bengsch B, Ruella M, Subklewe M, von Baumgarten L, Gill S, Prinz M, Zeiser R. Targeting TGFβ-activated kinase-1 activation in microglia reduces CAR T immune effector cell-associated neurotoxicity syndrome.
Nature Cancer. 2024 May 13. doi: 10.1038/s43018-024-00764-7.
Highlighted by: Targeting TAK1 in microglia to treat CAR T cell neurotoxicity. Nature Cancer. 2024, 5(8): 1143-1144.
Czech M*, Schneider S*, Peltokangas N*, El Khawanky N, Ghimire S, Andrieux G, Hülsdünker J, Krausz M, Proietti M, Braun LM, Rückert T, Langenbach M, Schmidt D, Martin I, Wenger V, de Vega E, Haring E, Pourjam M, Pfeifer D, Schmitt-Graeff A, Grimbacher B, Aumann K, Kircher B, Tilg H, Raffatellu M, Thiele Orberg E, Häcker G, Duyster J, Köhler N, Holler E, Nachbaur D, Boerries M, Gerner RR*, Grün D*, Zeiser R*. Lipocalin-2 expression identifies an intestinal regulatory neutrophil population during acute graft-versus-host disease.
Science Transl Med. 2024 Feb 21;16(735):eadi1501. doi: 10.1126/scitranslmed.adi1501.
Highlighted by:
Markey K. Lipocalin-2: a novel therapy for GVHD. Trends in Immunology 2024
Maas-Bauer K, Stell AV, Yan KL, de Vega E, Vinnakota JM, Unger S, Núñez N, Norona J, Talvard-Balland N, Koßmann S, Schwan C, Miething C, Martens US, Shoumariyeh K, Nestor RP, Duquesne S, Hanke K, Rackiewicz M, Hu Z, El Khawanky N, Taromi S, Andrlova H, Faraidun H, Walter S, Pfeifer D, Follo M, Waldschmidt J, Melchinger W, Rassner M, Wehr C, Schmitt-Graeff A, Halbach S, Liao J, Häcker G, Brummer T, Dengjel J, Andrieux G, Grosse R, Tugues S, Blazar BR, Becher B, Boerries M, Zeiser R. ROCK1/2 signaling contributes to corticosteroid-refractory acute graft-versus-host disease. Nature Commun. 2024 Jan 10;15(1):446.
Apostolova P, Kreutmair S, Toffalori C, Punta M, Unger S, Burk AC, Wehr C, Maas-Bauer K, Melchinger W, Haring E, Hoefflin R, Shoumariyeh K, Hupfer V, Lauer EM, Duquesne S, Lowinus T, Gonzalo Núñez N, Alberti C, da Costa Pereira S, Merten CH, Power L, Weiss M, Böke C, Pfeifer D, Marks R, Bertz H, Wäsch R, Ihorst G, Gentner B, Duyster J, Boerries M, Andrieux G, Finke J, Becher B, Vago L, Zeiser R.
Phase II trial of hypomethylating agent combined with nivolumab for acute myeloid leukaemia relapse after allogeneic haematopoietic cell transplantation-Immune signature correlates with response.
Br J Haematol. 2023 Aug 4. doi: 10.1111/bjh.19007.
Langenbach M, Giesler S, Richtsfeld S, da Costa-Pereira S, Rindlisbacher L, Wertheimer T, Braun LM, Andrieux G, Duquesne S, Pfeifer D, Woessner NM, Menssen HD, Taromi S, Duyster J, Boerries M, Brummer T, Blazar BR, Minguet S, Turko P, Levesque MP, Becher B, Zeiser R. MDM2 inhibition enhances immune checkpoint inhibitor efficacy by increasing IL-15 and MHC class II production. Mol Cancer Res. 2023 Apr 18:MCR-22-0898. doi: 10.1158/1541-7786.MCR-22-0898.
Ho JNHG, Schmidt D, Lowinus T, Ryoo J, Dopfer EP, Gonzalo Núñez N, Costa-Pereira S, Toffalori C, Punta M, Fetsch V, Wertheimer T, Rittmann MC, Braun LM, Follo M, Briere C, Vinnakota JM, Langenbach M, Koppers F, Shoumariyeh K, Engel H, Rückert T, Märklin M, Holzmayer S, Illert AL, Magon F, Andrieux G, Duquesne S, Pfeifer D, Staniek J, Rizzi M, Miething C, Köhler N, Duyster J, Menssen HD, Boerries M, Buescher JM, Cabezas-Wallscheid N, Blazar BR, Apostolova P, Vago L, Pearce EL, Becher B, Zeiser R.
Targeting MDM2 enhances anti-leukemia immunity after allogeneic transplantation via MHC-II and TRAIL-R1/2 upregulation.
Blood 140, 1167-1181 (2022). doi: 10.1182/blood.2022016082
Zeiser R, Socié G, Schroeder MA, Abhyankar S, Vaz CP, Kwon M, Clausen J, Volodin L, Giebel S, Chacon MJ, Meyers G, Ghosh M, Deeren D, Sanz J, Morariu-Zamfir R, Arbushites M, Lakshminarayanan M, Barbour AM, Chen YB. Efficacy and safety of itacitinib versus placebo in combination with corticosteroids for initial treatment of acute graft-versus-host disease (GRAVITAS-301): a randomised, multicentre, double-blind, phase 3 trial.
Lancet Haematol. 2022 Jan;9(1):e14-e25. doi: 10.1016/S2352-3026(21)00367-7.
El Khawanky N, Hughes A, Yu W, Myburgh R, Matschulla T, Taromi S, Aumann K, Clarson J, Vinnakota JM, Shoumariyeh K, Miething C, Lopez AF, Brown MP, Duyster J, Hein L, Manz MG, Hughes TP, White DL, Yong ASM, Zeiser R. Demethylating therapy increases anti-CD123 CAR T cell cytotoxicity against acute myeloid leukemia.
Nat Commun. 2021 Nov 8;12(1):6436.
Taromi S, Firat E, Simonis A, Braun LM, Apostolova P, Elze M, Passlick B, Schumacher A, Lagies S, Frey A, Schmitt-Graeff A, Burger M, Schmittlutz K, Follo M, von Elverfeldt D, Zhu X, Kammerer B, Diederichs S, Duyster J, Manz MG, Niedermann G, Zeiser R. Enhanced AC133-specific CAR T cell therapy induces durable remissions in mice with metastatic small cell lung cancer.
Cancer Lett. 2022 Jul 10;538:215697
Zeiser R, Polverelli N, Ram R, Hashmi SK, Chakraverty R, Middeke JM, Musso M, Giebel S, Uzay A, Langmuir P, Hollaender N, Gowda M, Stefanelli T, Lee SJ, Teshima T, Locatelli F; REACH3 Investigators. Ruxolitinib for Glucocorticoid-Refractory Chronic Graft-versus-Host Disease.
N Engl J Med. 2021 Jul 15;385(3):228-238. doi: 10.1056/NEJMoa2033122. PMID: 34260836.
Osswald L, Hamarsheh S, Uhl FM, Andrieux G, Klein C, Dierks C, Duquesne S, Braun LM, Schmitt-Graeff A, Duyster J, Boerries M, Brummer T, Zeiser R.
Oncogenic KrasG12D Activation in the Nonhematopoietic Bone Marrow Microenvironment Causes Myelodysplastic Syndrome in Mice.
Mol Cancer Res. 2021 Jun 4. doi: 10.1158/1541-7786.MCR-20-0275.
Uhl FM, Chen S, O'Sullivan D, Edwards-Hicks J, Richter G, Haring E, Andrieux G, Halbach S, Apostolova P, Büscher J, Duquesne S, Melchinger W, Sauer B, Shoumariyeh K, Schmitt-Graeff A, Kreutz M, Lübbert M, Duyster J, Brummer T, Boerries M, Madl T, Blazar BR, Groß O, Pearce EL, Zeiser R.
Metabolic reprogramming of donor T cells enhances graft-versus-leukemia effects in mice and humans.
Science Translational Medicine 2020 Oct 28;12(567):eabb8969.
Norona J, Apostolova P, Schmidt D, Ihlemann R, Reischmann N, Taylor G, Köhler N, de Heer J, Heeg S, Andrieux G, Siranosian BA, Schmitt-Graeff A, Pfeifer D, Catalano A, Frew I, Proietti M, Grimbacher B, Bulashevska A, Bhatt AS, Brummer T, Clauditz TS, Zabelina T, Kroeger N, Blazar BR, Boerries M, Ayuk F, Zeiser R.
Glucagon like peptide-2 for Intestinal stem cell and Paneth cell repair during graft-versus-host disease in mice and humans.
Blood. 2020; 136: 1442-1455.
Highlighted in: Chao N. Blood 2020
Zeiser R, von Bubnoff N, Butler J, Mohty M, Niederwieser D, Or R, Szer J, Wagner EM, Zuckerman T, Mahuzier B, Xu J, Wilke C, Gandhi KK, Socié G, for the REACH2 Trial Group.
Ruxolitinib for Glucocorticoid-Refractory Acute Graft-versus-Host Disease.
The New England Journal of Medicine 2020 May 7;382(19):1800-1810
Highlighted in Chao N. Finally, a Successful Randomized Trial for GVHD. N Engl J Med. 2020
R Mathew N, Vinnakota JM, Apostolova P, Erny D, Hamarsheh S, Andrieux G, Kim JS, Hanke K, Goldmann T, Chappell-Maor L, El-Khawanky N, Ihorst G, Schmidt D, Duyster J, Finke J, Blank T, Boerries M, Blazar BR, Jung S, Prinz M, Zeiser R.
Graft-versus-host disease of the CNS is mediated by TNF upregulation in microglia.
J Clin Invest. 2020 Mar 2;130(3):1315-1329
Hülsdünker J, Thomas OS, Haring E, Unger S, Gonzalo Núñez N, Tugues S, Gao Z, Duquesne S, Cywes-Bentley C, Oyardi O, Kirschnek S, Schmitt-Graeff A, Pabst O, Koenecke C, Duyster J, Apostolova P, Blaser MJ, Becher B, Pier GB, Häcker G, Zeiser R.
Immunization against poly-N-acetylglucosamine reduces neutrophil activation and GVHD while sparing microbial diversity.
Proc Natl Acad Sci U S A. 2019 Oct 8;116(41):20700-20706
Prestipino A, Emhardt A, Aumann K, O´Sullivan D, Gorantla SP, Duquesne S, Melchinger W, Braun L, Vuckovic S, Boerries M, Busch H, Halbach S, Pennisi S, Poggio T, Apostolova P, Veratti P, Hettich M, Niedermann G, Bartholomä M, Shoumariyeh K, Jutzi J, Wehrle J, Dierks C, Becker H, Schmitt-Graeff A, Follo M, Pfeifer D, Rohr J, Fuchs S, Ehl S, Hartl FA, Minguet S, Miething C, Heidel F, Kröger N, Triviai I, Brummer T, Finke J, Illert AL, Ruggiero E, Bonini C, Duyster J, Pahl HL, Lane SW, Hill GR, Blazar BR, Bubnoff N, Pearce EL, Zeiser R.
Oncogenic JAK2V617F causes PD-L1 expression mediating immune-escape in myeloproliferative neoplasms
Science Translational Medicine 10, eaam7729 2018
Mathew NR, Baumgartner F, Braun L, David O´Sullivan, Thomas S, Waterhouse M, Müller TA, Hanke K, Taromi S, Apostolova P, Illert AL, Melchinger W, Duquesne S, Schmitt-Graeff A, Osswald L, Yan K-L., Weber A, Tugues S, Spath S, Pfeifer D, Follo M, Claus R, Lübbert M, Rummelt C, Bertz H, Wäsch R, Haag J, Schmidts A, Schultheiss M, Bettinger M, Thimme R, Ullrich E, Tanriver Y, Vuong GL, Arnold R, Hemmati P, Wolf D, Ditschkowski M, Jilg C, Wilhelm K, Leiber C, Gerull S, Halter J, Lengerke C, Pabst T, Schroeder T, Kobbe G, Rösler W, Doostkam S, Meckel S, Stabla K, Metzelder SK, Halbach S, Brummer T, Hu Z, Dengjel J, Hackanson B, Schmid C, Holtick U, Scheid C, Spyridonidis A, Stölzel F, Ordemann F, Müller LP, Sicre-de-Fontbrune F, Ihorst G, Kuball J, Ehlert JE, Feger D, Wagner EV, Cahn JY, Schnell J, Kuchenbauer F, Bunjes D, Chakraverty R, Richardson S, Gill S, Kröger N, Ayuk F, Vago L, Ciceri F, Müller AM, Kondo T, Teshima T, Klaeger S, Kuster B, Kim D, Weisdorf D, van der Velden W, Dörfel D, Bethge W, Hilgendorf I, Hochhaus A, Andrieux G, Börries M, Busch H, Magenau J, Reddy P, Labopin M, H. Antin J, Henden AS, Hill GR, Kennedy GA, Bar M, Sarma A, McLornan D, Mufti G, Oran B, Rezvani K, Sha O, Negrin RS, Nagler A, Prinz M, Burchert A, Neubauer A, Beelen D, Mackensen A, von Bubnoff N, Herr W, Becher B, Socié G, Caligiuri MA, Ruggiero E, Bonini C, Häcker G, Duyster J, Finke J, Pearce E, Blazar BR, Zeiser R.
Sorafenib promotes graft-versus-leukemia activity in mice and humans through IL-15 production in FLT3-ITD mutant leukemia cells.
Nature Medicine 2018 Mar;24(3):282-291
Hülsdünker J, Ottmüller KJ, Neeff HP, Koyama M, Gao Z, Thomas OS, Follo M, Al-Ahmad A, Prinz G, Duquesne S, Dierbach H, Kirschnek S, Lämmermann T, Blaser MJ, Fife BT, Blazar BR, Beilhack A, Hill GR, Häcker G, Zeiser R.
Neutrophils provide cellular communication between ileum and mesenteric lymph nodes at graft-versus-host disease onset.
Blood. 2018 Apr 19;131(16):1858-1869.
Highlighted in Martin PJ. Blood. 2018;131(16):1774-1775
Stickel N, Hanke K, Marschner D, Prinz G, Köhler M, Melchinger W, Pfeifer D, Schmitt-Graeff A, Brummer T, Heine A, Brossart P, Wolf D, von Bubnoff N, Finke J, Duyster J, Ferrara J, Salzer U, Zeiser R. MicroRNA-146a reduces MHC-II expression via targeting JAK/STAT signaling in dendritic cells after stem cell transplantation.
Leukemia. 2017 Dec;31(12):2732-2741
Andrlová H, Mastroianni J, Madl J, Kern JS, Melchinger W, Dierbach H, Wernet F, Follo M, Technau-Hafsi K, Has C, Mittapalli VR, Idzko M, Herr R, Brummer T, Ungefroren H, Busch H,
Boerries M, Narr A, Ihorst G, Vennin C, Schmitt-Graeff A, Minguet S, Timpson P, Duyster J, Meiss F, Römer W, Zeiser R. Biglycan expression in the melanoma microenvironment promotes invasiveness via increased tissue stiffness inducing integrin-β1 expression.
Oncotarget. Apr 17. doi: 10.18632/oncotarget.17160, 2017
Schönle A, Hartl FA, Mentzel J, Nöltner T, Rauch KS, Prestipino A, Wohlfeil SA, Apostolova P, Hechinger AK, Melchinger W, Fehrenbach K, Guadamillas MC, Follo M, Prinz G, Ruess AK, Pfeifer D, Del Pozo MA, Schmitt-Graeff A, Duyster J, Hippen KI, Blazar BR, Schachtrup K, Minguet S, Zeiser R. Caveolin-1 regulates TCR signal strength and regulatory T cell differentiation into alloreactive T cells.
Blood 127:1930-9, 2016
Zeiser R, Burchert A, Lengerke C, Verbeek M, Maas-Bauer K, Metzelder SK, Spoerl S, Ditschkowski M, Ecsedi M, Sockel K, Ayuk F, Ajib S, de Fontbrune FS, Na IK, Penter L, Holtick U, Wolf D, Schuler E, Meyer E, Apostolova P, Bertz H, Marks R, Lübbert M, Wäsch R, Scheid C, Stölzel F, Ordemann R, Bug G, Kobbe G, Negrin R, Brune M, Spyridonidis A, Schmitt-Gräff A, van der Velden W, Huls G, Mielke S, Grigoleit GU, Kuball J, Flynn R, Ihorst G, Du J, Blazar BR, Arnold R, Kröger N, Passweg J, Halter J, Socié G, Beelen D, Peschel C, Neubauer A, Finke J, Duyster J, von Bubnoff N. Ruxolitinib in corticosteroid-refractory graft-versus-host disease after allogeneic stem cell transplantation: a multi-center survey.
Leukemia 29: 2062-8, 2015
Hechinger AK, Smith BA, Flynn R, Hanke K, McDonald-Hyman C, Taylor PA, Pfeifer D, Hackanson B, Leonhardt F, Prinz G, Dierbach H, Schmitt-Graeff A, Kovarik J, Blazar BR, Zeiser R. Therapeutic activity of multiple common gamma chain cytokine inhibition in acute and chronic GvHD.
Blood 125: 570-80, 2015
Highlighted in Pérez-Simón JA. Blood 125: 424-6. 2015
Schwab, L, Goroncy, L, Palaniyandi, S., Gautam, S., Triantafyllopoulou, A., Mocsai, A, Reichardt, W., Karlsson, FJ, Radhakrishnan, SV, Hanke, K, Schmitt-Graeff, A, Freudenberg, M, von Loewenich, FD, Wolf, P, Leonhardt, F, Baxan, N, Pfeifer, D, Schmah, O, Schönle, A, Martin, SF, Mertelsmann, R, Duyster, J, Finke, J., Prinz, M., Henneke, P., Häcker, H., Hildebrandt, G.C, Häcker, G, Zeiser, R. Neutrophil granulocytes recruited upon translocation of intestinal bacteria enhance GvHD via tissue damage.
Nature Medicine 20: 648-54, 2014
Highlighted in Kugelberg E. Nature Reviews Immunology, 2014
Yaktapour N, Meiss F, Mastroianni J, Zenz T, Andrlova H, Mathew NR, Claus R, Hutter B, Fröhling S, Brors B, Pfeifer D, Pantic M, Bartsch I, Spehl TS, Meyer PT, Duyster J, Zirlik K, Brummer T, Zeiser R. BRAF inhibitor-associated ERK activation drives development of chronic lymphocytic leukemia.
J Clin Invest. 124: 5074-84, 2014
Highlighted in Wu C.J. J Clin Invest. 124:4681-3, 2014
Jankovic D, Ganesan J, Bscheider M, Stickel N, Weber F, Guarda G, Follo M, Pfeifer D, Tardivel A, Ludigs K, Bouazzaoui A, Kerl K, Fischer J, Haas T, Schmitt-Gräff A, Manoharan A, Müller L, Finke J, Martin S, Gorka O, Peschel C, Ruland J, Idzko M, Duyster J, Holler E, French LE, Poeck H*, Contassot E, Zeiser R. The Nlrp3-inflammasome regulates acute graft-versus-host disease.
J Exp Med 210:1899-910, 2013
Leonhardt F, Grundmann S, Behe M, Bluhm F, Dumont, RA, Braun F, Melpomeni F, Riesner K, Prinz G, Hechinger AK, Gerlach UV, Dierbach H, Penack O, Schmitt-Gräff A, Finke J, Weber WA, Zeiser R. Inflammatory neovascularization during graft-versus-host disease is regulated by αv integrin and miR-100.
Blood 121:3307-3318, 2013
Highlighted in Komanduri KV et al. Blood 121:3303-4, 2014
Wilhelm, K, Ganesan J, Müller T, Dürr C, Grimm, M, Beilhack, A, Krempl, CD, Sorichter, S, Gerlach, UV, Jüttner, E, Zerweck, A, Gärtner, F, Pellegatti, P, Di Virgilio, F, Ferrari, D, Kambham, N, Fisch, P, Finke, J, Idzko, M, Zeiser, R. Graft-versus-host disease is enhanced by extracellular adenosine triphosphate activating P2X7R.
Nature Medicine 12: 1434-1438, 2010

Zeiser R, Spyridonidis A, Wasch R, Ihorst G, Grullich C, Bertz H, Finke J. Evaluation of immunomodulatory treatment based on conventional and lineage-specific chimerism analysis in patients with myeloid malignancies after myeloablative allogeneic hematopoietic cell transplantation.
Leukemia 19: 814-821, 2005.
- Prestipino A, Emhardt A, Aumann K, O´Sullivan D, Gorantla SP, Duquesne S, Melchinger W, Braun L, Vuckovic S, Boerries M, Busch H, Halbach S, Pennisi S, Poggio T, Apostolova P, Veratti P, Hettich M, Niedermann G, Bartholomä M, Shoumariyeh K, Jutzi J, Wehrle J, Dierks C, Becker H, Schmitt-Graeff A, Follo M, Pfeifer D, Rohr J, Fuchs S, Ehl S, Hartl FA, Minguet S, Miething C, Heidel F, Kröger N, Triviai I, Brummer T, Finke J, Illert AL, Ruggiero E, Bonini C, Duyster J, Pahl HL, Lane SW, Hill GR, Blazar BR, Bubnoff N, Pearce EL, Zeiser R.
Oncogenic JAK2V617F causes PD-L1 expression mediating immune-escape in myeloproliferative neoplasms.
Science Translational Medicine 10 (429), 2018 - Mathew NR, Baumgartner F, Braun L, David O´Sullivan, Thomas S, Waterhouse M, Müller TA, Hanke K, Taromi S, Apostolova P, Illert AL, Melchinger W, Duquesne S, Schmitt-Graeff A, Osswald L, Yan K-L., Weber A, Tugues S, Spath S, Pfeifer D, Follo M, Claus R, Lübbert M, Rummelt C, Bertz H, Wäsch R, Haag J, Schmidts A, Schultheiss M, Bettinger M, Thimme R, Ullrich E, Tanriver Y, Vuong GL, Arnold R, Hemmati P, Wolf D, Ditschkowski M, Jilg C, Wilhelm K, Leiber C, Gerull S, Halter J, Lengerke C, Pabst T, Schroeder T, Kobbe G, Rösler W, Doostkam S, Meckel S, Stabla K, Metzelder SK, Halbach S, Brummer T, Hu Z, Dengjel J, Hackanson B, Schmid C, Holtick U, Scheid C, Spyridonidis A, Stölzel F, Ordemann F, Müller LP, Sicre-de-Fontbrune F, Ihorst G, Kuball J, Ehlert JE, Feger D, Wagner EV, Cahn JY, Schnell J, Kuchenbauer F, Bunjes D, Chakraverty R, Richardson S, Gill S, Kröger N, Ayuk F, Vago L, Ciceri F, Müller AM, Kondo T, Teshima T, Klaeger S, Kuster B, Kim D, Weisdorf D, van der Velden W, Dörfel D, Bethge W, Hilgendorf I, Hochhaus A, Andrieux G, Börries M, Busch H, Magenau J, Reddy P, Labopin M, H. Antin J, Henden AS, Hill GR, Kennedy GA, Bar M, Sarma A, McLornan D, Mufti G, Oran B, Rezvani K, Sha O, Negrin RS, Nagler A, Prinz M, Burchert A, Neubauer A, Beelen D, Mackensen A, von Bubnoff N, Herr W, Becher B, Socié G, Caligiuri MA, Ruggiero E, Bonini C, Häcker G, Duyster J, Finke J, Pearce E, Blazar BR, Zeiser R. Sorafenib promotes graft-versus-leukemia activity in mice and humans through IL-15 production in FLT3-ITD mutant leukemia cells.
Nature Medicine 24: 282-291, 2018 - Clinical implications of tumor-intrinsic mechanisms regulating PD-L1.
Prestipino A, Zeiser R.
Sci Transl Med. 2019 Feb 6;11(478). - Schwab, L, Goroncy, L, Palaniyandi, S., Gautam, S., Triantafyllopoulou, A., Mocsai, A, Reichardt, W., Karlsson, FJ, Radhakrishnan, SV, Hanke, K, Schmitt-Graeff, A, Freudenberg, M, von Loewenich, FD, Wolf, P, Leonhardt, F, Baxan, N, Pfeifer, D, Schmah, O, Schönle, A, Martin, SF, Mertelsmann, R, Duyster, J, Finke, J., Prinz, M., Henneke, P., Häcker, H., Hildebrandt, G.C, Häcker, G, Zeiser, R.
Neutrophil granulocytes recruited upon translocation of intestinal bacteria enhance GvHD via tissue damage.
Nature Medicine 20: 648-54, 2014 - Yaktapour N, Meiss F, Mastroianni J, Zenz T, Andrlova H, Mathew NR, Claus R, Hutter B, Fröhling S, Brors B, Pfeifer D, Pantic M, Bartsch I, Spehl TS, Meyer PT, Duyster J, Zirlik K, Brummer T, Zeiser R.
BRAF inhibitor-associated ERK activation drives development of chronic lymphocytic leukemia.
J Clin Invest. 124: 5074-84, 2014 - Jankovic D, Ganesan J, Bscheider M, Stickel N, Weber F, Guarda G, Follo M, Pfeifer D, Tardivel A, Ludigs K, Bouazzaoui A, Kerl K, Fischer J, Haas T, Schmitt-Gräff A, Manoharan A, Müller L, Finke J, Martin S, Gorka O, Peschel C, Ruland J, Idzko M, Duyster J, Holler E, French LE, Poeck H*, Contassot E, Zeiser R.
The Nlrp3-inflammasome regulates acute graft-versus-host disease.
J Exp Med 210:1899-910, 2013 - Wilhelm, K, Ganesan J, Müller T, Dürr C, Grimm, M, Beilhack, A, Krempl, CD, Sorichter, S, Gerlach, UV, Jüttner, E, Zerweck, A, Gärtner, F, Pellegatti, P, Di Virgilio, F, Ferrari, D, Kambham, N, Fisch, P, Finke, J, Idzko, M, Zeiser, R.
Graft-versus-host disease is enhanced by extracellular adenosine triphosphate activating P2X7R.
Nature Medicine 12: 1434-1438, 2010