Leistungsverzeichnis
| Material | 200µl EDTA Blut | |
| Methode | Durchflusszytometrie, Oberflächenfärbung | |
| Testbeschreibung | Identifizierung im peripheren Blut vorhandener Lymphozyten-Populationen mittels Analyse fluoreszenz-markierter Antikörper gegen spezifische Zell-Oberflächenproteine | |
| Krankheitsbilder | SCID, CID, CVID, Screening bei vielen Immundefekten | |
| Kontrollblut | nein | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | siehe Befund, altersabhängig für die meisten Populationen vorhanden | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 300µl EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung | |
| Testbeschreibung | Identifizierung im peripheren Blut vorhandener T-Zell-Populationen mittels Analyse fluoreszenz-markierter Antikörper gegen spezifische Zell-Oberflächenproteine | |
| Krankheitsbilder | SCID, CID, CVID, Screening bei vielen Immundefekten | |
| Kontrollblut | nein | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | siehe Befund, altersabhängig für die meisten Populationen vorhanden | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 1ml EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung | |
| Testbeschreibung | Identifizierung im peripheren Blut vorhandener B-Zell-Populationen mittels Analyse fluoreszenz-markierter Antikörper gegen spezifische Zell-Oberflächenproteine | |
| Krankheitsbilder | CID, CVID, Screening bei vielen Immundefekten | |
| Kontrollblut | nein | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | siehe Befund, altersabhängig für die meisten Populationen vorhanden | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 1ml EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung | |
| Testbeschreibung | Identifizierung des TCR-Vß-Repertoires (= unterschiedliche Varianten der ß-Kette des TCR durch VDJ-Rekombination; hier 23 verschiedene Varianten) von CD4+ und CD8+ T-Lymphozyten durch FACS Analyse | |
| Krankheitsbilder | T-Zell Lymphopenie oder T-Zell Lymphozytose | |
| Kontrollblut | nein | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | siehe Befund | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 500µl EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung | |
| Testbeschreibung | Nachweis lymphoider/plasmozytoider und myeloider dendritischer Zellen im peripheren Blut mittels FACS Analyse spezifischer Oberflächenmarker | |
| Krankheitsbilder | GATA2 Defekt | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | pDC: 0,017% - 0,306%; mDC: 0,05% - 0,699% | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 300µl EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung | |
| Testbeschreibung | Nachweis der sogenannten MAIT Zellen im peripheren Blut mittels FACS Analyse spezifischer Oberflächenmarker | |
| Krankheitsbilder | XLP2 | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Expressionsnachweis im Vergleich zu Tageskontrolle | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 1ml EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung | |
| Testbeschreibung | Nachweis der sogenannten NKT-Zellen im peripheren Blut mittels FACS Analyse spezifischer Oberflächenmarker | |
| Krankheitsbilder | XLP1 | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | > 0,01% in CD3+ T-Zellen | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 200µl EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung | |
| Testbeschreibung | Nachweis CD4-/CD8- TCRab+ T-Zellen, sog. DNT Zellen, im peripheren Blut mittels FACS Analyse spezifischer Oberflächenmarker | |
| Krankheitsbilder | ALPS, AL-PID | |
| Kontrollblut | nein | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | < 2,5% TCRab+CD4-CD8- Zellen von CD3+ T-Zellen | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 3ml EDTA Blut | |
| Methode | Durchflusszytometrie; Intrazellulärfärbung | |
| Testbeschreibung | Nachweis regulatorischer T-Zellen im peripheren Blut mittels FACS Analyse des spezifischen, intrazellulären Markers FoxP3 | |
| Krankheitsbilder | IPEX, early-onset IBD, Poly-Autoimmunität | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | 1,7% - 9,4% | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 300µl EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung | |
| Testbeschreibung | Nachweis des β2-Integrins CD18 und der alpha-Kette CD11b mittels FACS Analyse auf Neutrophilen und Monozyten | |
| Krankheitsbilder | LAD Typ 1 | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Expressionsnachweis im Vergleich zu Tageskontrolle | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 200µl EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung | |
| Testbeschreibung | Nachweis des B-Zell Rezeptors CD40 mittels FACS Analyse auf B-Zellen | |
| Krankheitsbilder | HIGM | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Expressionsnachweis im Vergleich zu Tageskontrolle | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 400µl EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung; Funktionstest | |
| Testbeschreibung | Nachweis der CD40 Liganden Expression auf aktivierten T-Zellen nach deren Stimulation mit PMA und Ionomycin mittels FACS Analyse spezifischer Oberflächenmarker | |
| Krankheitsbilder | HIGM | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | CD40L > 70%; CD69+ > 90% | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 300µl EDTA Blut | |
| Methode | Durchflusszytometrie; Intrazellulärfärbung | |
| Testbeschreibung | Nachweis der intrazellulär exprimierten Bruton-Tyrosinkinase (BTK) in Monozyten mittels FACS Analyse | |
| Krankheitsbilder | XLA | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Expressionsnachweis im Vergleich zu Tageskontrolle | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 300µl EDTA Blut | |
| Methode | Durchflusszytometrie; Intrazellulärfärbung | |
| Testbeschreibung | Nachweis des intrazellulär exprimierten Proteins SAP in T- und NK-Zellen mittels FACS Analyse | |
| Krankheitsbilder | XLP1, HLH; da X-linked nur bei männlichen Patienten | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Expressionsnachweis im Vergleich zu Tageskontrolle | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 300µl EDTA Blut | |
| Methode | Durchflusszytometrie; Intrazellulärfärbung | |
| Testbeschreibung | Nachweis des intrazellulär exprimierten Proteins XIAP in T- und NK-Zellen mittels FACS Analyse | |
| Krankheitsbilder | XLP2, HLH, IBD; da X-linked nur bei männlichen Patienten | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Expressionsnachweis im Vergleich zu Tageskontrolle | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 300µl EDTA Blut | |
| Methode | Durchflusszytometrie; Intrazellulärfärbung | |
| Testbeschreibung | Nachweis des intrazellulär exprimierten WAS-Proteins in NK- und B-Zellen mittels FACS Analyse | |
| Krankheitsbilder | WAS | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Expressionsnachweis im Vergleich zu Tageskontrolle | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 200µl EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung | |
| Testbeschreibung | Nachweis des Rezeptors NKG2D auf NK-Zellen mittels FACS Analyse | |
| Krankheitsbilder | MAGT1 | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Expressionsnachweis im Vergleich zu Tageskontrolle | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 5ml EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung; Funktionstest | |
| Testbeschreibung | Untersuchung der Proliferationsfähigkeit von CD4+ und CD8+ T-Zellen nach TCR-unabhängiger Stimulation mit PHA bzw. TCR-abhängiger Stimulation mit unterschiedlichen Konzentrationen des CD3-Antigens mit und ohne Kostimulation durch CD28, durch die Detektion der Verdünnung von intrazellulärem CFSE mittels FACS Analyse | |
| Krankheitsbilder | SCID, CID, CVID, Screening bei vielen Immundefekten | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Vergleich mit Tageskontrolle | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 5-7 Tage |
| Material | 2ml EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung; Funktionstest | |
| Testbeschreibung | Nachweis der Expression der oberflächlichen Aktivierungsmarker CD25 und CD69 auf T-Zellen nach Stimulation mit PHA bzw. anti-CD3/CD28-Beads mittels FACS Analyse | |
| Krankheitsbilder | SCID, CID | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | nach PHA: 31% - 82% CD25/CD69+ von CD4+ Zellen nach anti-CD3/CD28-Beads: 15% - 81% CD25/CD69+ von CD4+ Zellen nach PHA: 37% - 80% CD25/CD69+ von CD8+ Zellen nach anti-CD3/CD28-Beads: 6,7% - 72% CD25/CD69+ von CD8+ Zellen | |
| Analysetage | Montag - Donnerstag | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 2 Tage |
| Material | 3ml EDTA Blut | |
| Methode | Durchflusszytometrie; Intrazellulärfärbung; Funktionstest | |
| Testbeschreibung | Nachweis der intrazellulären Aktivierungsmarker IFNγ und IL-2 in T-Zellen (Th1 Zellen) nach Stimulation mit PMA und Ionomycin mittels FACS Analyse | |
| Krankheitsbilder | Ca-Kanal-Defekte (ORAI1, STIM1) | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | IL2: 28,3% - 58% von CD45RO CD4+ T Zellen | |
| Analysetage | Montag - Donnerstag | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 2 Tage |
| Material | 3ml EDTA Blut | |
| Methode | Durchflusszytometrie; Intrazellulärfärbung; Funktionstest | |
| Testbeschreibung | Nachweis der intrazellulären Aktivierungsmarker IFNγ (Th1 Zellen) und IL-4 (Th2 Zellen) in T-Zellen nach Stimulation mit PMA und Ionomycin mittels FACS Analyse | |
| Krankheitsbilder | ||
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | IL4: 3,6% - 12,2% von CD45RO CD4+ T Zellen IFNg: 15,6% - 29% von CD45RO CD4+ T Zellen IFNg/IL4 Ratio: 1,9 - 7,1 | |
| Analysetage | Montag - Donnerstag | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 2 Tage |
| Material | 3ml EDTA Blut | |
| Methode | Durchflusszytometrie; Intrazellulärfärbung; Funktionstest | |
| Testbeschreibung | Nachweis der intrazellulären Aktivierungsmarker IFNγ (Th1 Zellen) und IL-17 (Th17 Zellen) in T-Zellen nach Stimulation mit PMA und Ionomycin mittels FACS Analyse | |
| Krankheitsbilder | CMC, HIES | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | IL17: 1,1% - 4,8% von CD45RO CD4+ T Zellen IFNg: 16,4% - 32,6% von CD45RO CD4+ T Zellen IFNg Kinder 6-24 Monate: 4,3% - 15,8% von CD45RO CD4+ T Zellen | |
| Analysetage | Montag - Donnerstag | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 2 Tage |
| Material | 5ml EDTA Blut | |
| Methode | Durchflusszytometrie; Intrazellulärfärbung; Funktionstest | |
| Testbeschreibung | Nachweis der Phosphorylierung des intrazellulären Transkriptionsfaktors STAT1 in Monozyten und Lymphozyten nach Stimulation mit IFNγ und IFNα mittels FACS Analyse | |
| Krankheitsbilder | CMC | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Vergleich mit Tageskontrolle | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 5ml EDTA Blut | |
| Methode | Durchflusszytometrie; Intrazellulärfärbung; Funktionstest | |
| Testbeschreibung | Nachweis der Phosphorylierung des intrazellulären Transkriptionsfaktors STAT5 in T-Zellen nach Stimulation mit IL-2 mittels FACS Analyse | |
| Krankheitsbilder | X-SCID | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Vergleich mit Tageskontrolle | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 5ml EDTA Blut | |
| Methode | Durchflusszytometrie; Intrazellulärfärbung; Funktionstest | |
| Testbeschreibung | Nachweis der Phosphorylierung des intrazellulären Transkriptionsfaktors STAT6 in B-Zellen nach Stimulation mit IL-4 mittels FACS Analyse | |
| Krankheitsbilder | X-SCID | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Vergleich mit Tageskontrolle | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 5ml EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung; Funktionstest | |
| Testbeschreibung | Untersuchung der Kalzium-Aufnahme von T-Zellen nach TCR-unabhängier (Thapsigargin) und TCR-abhängiger (Fab-Fragment) Stimulation durch Messung des Verhältnisses von intrazellulärem Kalzium-gebundenen und ungebundenen Indo-1 mittels FACS Analyse | |
| Krankheitsbilder | Ca-Kanal-Defekte (ORAI1, STIM1) | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Vergleich mit Tageskontrolle | |
| Analysetage | nur nach Rücksprache | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1-2 Tage |
| Material | 5ml EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung; Funktionstest | |
| Testbeschreibung | Bestimmung der Expression des Degranulationsmarkers CD107a auf NK-Zellen nach Stimulation mit Zielzellen mittels FACS Analyse | |
| Krankheitsbilder | HLH | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | > 10% der NK Zellen CD107a+ | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
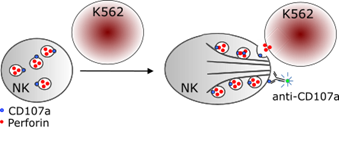
Beim NK-Degranulationstest werden NK-Zellen auf ihre Fähigkeit getestet, nach Aktivierung Perforin-haltige lytische Granula auszuschütten (Degranulation). Dieser Vorgang ist die Grundlage der Perforin-vermittelten Zytotoxizität, bei dem Zielzellen durch NK-Zellen abgetötet werden.
Für den NK-Degranulationstest werden mononukleäre Zellen des peripheren Blutes (PBMCs) isoliert, die NK-Zellen enthalten. Die PBMC werden mit K562-Zellen (einer Tumorzelllinie) stimuliert, die kein MHC Klasse I und II Antigen auf ihrer Oberfläche exprimieren. NK-Zellen erkennen Zellen, denen MHC Moleküle fehlen, und werden durch diese Zellen Calcium-abhängig aktiviert. Dies führt dazu, dass sich das Aktin-abhängige Zytoskelett neu auf die Kontaktstelle zwischen NK-Zelle und K562 Zielzelle ausrichtet. Perforin-haltige Granula, die zufällig in der Zelle verteilt sind, werden in den aktivierten NK-Zellen entlang des Zytoskeletts an die Kontaktstelle transportiert. Dort „docken sie an“, verschmelzen mit der Zellmembran und schütten ihren Inhalt (Perforin, Granzyme) in den Spalt zwischen den beiden Zellen aus. Die Perforin-Moleküle schlagen „Löcher“ in die Zielzellen, durch die Granzyme eindringen können und Zelltod in der Zielzelle auslösen. Die Membran der Granula enthält das Protein CD107a, welches nach dem Verschmelzen der Granulamembran mit der Zellmembran auf der Zelloberfläche der NK-Zelle erkennbar wird. Der Nachweis einer vermehrten Expression von CD107a auf aktivierten NK-Zellen (im Vergleich zu ruhenden NK-Zellen) ist daher ein Maß für ihre zytotoxische Aktivität.
CD107a kann durch Zugabe eines anti-CD107a Antikörpers angefärbt und die Expression mittels Durchflusszytometrie detektiert werden. CD107a muss während der Stimulation im Medium vorhanden sein, da der Degranulationsprozess sehr dynamisch ist und CD107a auch rasch wieder in das Zellinnere recycelt wird. NK-Zellen exprimieren kein CD3 und werden über die Expression der Oberflächenmoleküle CD56 (NCAM Antigen) und CD16 (IgG Fc III Rezeptor) von B-Zellen abgegrenzt.
Krankheitsbilder
- Die Aktivierung der NK-Zellen ist Calcium-abhängig, dies erklärt die reduzierte NK-Degranulation bei Defekten von ORAI- und STIM, die wichtig für den Calcium-Einstrom von NK-Zellen sind.
- Bei Defekten, die zu einer Störung des Zytoskeletts führen (WAS, DOCK8, HEM1, ARPC1B), kann die Bildung der Kontaktstelle zwischen NK-Zelle und Zielzelle gestört sein, was die Degranulation beeinträchtigt.
- Bei Gendefekten, die die Reifung, den Transport, das Anheften oder Verschmelzen der zytotoxischen Granula beeinflussen (Defekte in UNC13D, STXBP2, STX11, RhoG, RAB27A, LYST), ist die NK-Zell Degranulation gestört.
- Bei Perforin-Defizienz ist die NK-Zell Degranulation NICHT gestört
- In Situationen starker Immunaktivierung kann die NK-Zelldegranulation auch moderat beeinträchtigt sein, ohne dass ein genetischer Defekt zugrunde liegt.
| Material | 5ml EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung; Funktionstest | |
| Testbeschreibung | Bestimmung der Expression des Degranulationsmarkers CD107a auf NK-Zellen nach Vorstimulation der NK-Zellen mit IL-2 und PHA sowie nachfolgender Stimulation mit Zielzellen mittels FACS Analyse | |
| Krankheitsbilder | HLH | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | > 35% der NK Zellen CD107a+ | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 3-5 Tage |
| Material | 5ml EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung; Funktionstest | |
| Testbeschreibung | Bestimmung der Expression des Degranulationsmarkers CD107a auf T-Zellen nach Vorstimulation der T-Zellen mit IL-2 und PHA sowie nachfolgender Stimulation des TCRs mit anti-CD3/CD28-Beads mittels FACS Analyse | |
| Krankheitsbilder | HLH | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Vergleich mit Tageskontrolle | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 3-5 Tage |
| Material | 1ml EDTA Blut | |
| Methode | Durchflusszytometrie; Intrazellulärfärbung | |
| Testbeschreibung | Nachweis der intrazellulären Expression von Perforin in NK-Zellen mittels FACS Analyse | |
| Krankheitsbilder | HLH | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Expressionsnachweis im Vergleich zu Tageskontrolle | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 5ml EDTA Blut | |
| Methode | Durchflusszytometrie; Intrazellulärfärbung; Funktionstest | |
| Testbeschreibung | Bestimmung der intrazellulären Expression von TNF in Monozyten nach Stimulation mit hoher und niedriger Dosis LPS mittels FACS Analyse | |
| Krankheitsbilder | IRAK-4, MyD88 | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | siehe Befund | |
| Analysetage | Montag - Donnerstag | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 2 Tage |
| Material | 5ml EDTA Blut | |
| Methode | Durchflusszytometrie; Intrazellulärfärbung; Funktionstest | |
| Testbeschreibung | Bestimmung der intrazellulären Expression von TNF in Monozyten nach Stimulation mit LPS und L18MDP mittels FACS Analyse | |
| Krankheitsbilder | XLP2, IBD | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | siehe Befund | |
| Analysetage | Montag - Donnerstag | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 2 Tage |
| Material | 5ml EDTA Blut | |
| Methode | Durchflusszytometrie; Intrazellulärfärbung; Funktionstest | |
| Testbeschreibung | Beurteilung der IL10R-Funktion durch die Bestimmung der intrazellulären Expression von TNF in Monozyten nach Vorstimulation mit verschiedenen IL10-Konzentrationen und anschließender Stimulation mit LPS mittels FACS Analyse | |
| Krankheitsbilder | very early onset IBD | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | > 60% TNF in Monozyten ohne IL-10 > 40% Inhibition bei IL-10 20ng | |
| Analysetage | Montag - Donnerstag | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 2 Tage |
| Material | 5ml EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung; Funktionstest | |
| Testbeschreibung | Beurteilung der Interferon-Funktion von Monozyten durch Bestimmung der intrazellulären VSV-GFP Menge nach Vorstimulation mit verschiedenen IFNα-Konzentrationen mittels FACS Analyse | |
| Krankheitsbilder | IFNAR, TYK2, STAT1, STAT2 | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | siehe Befund | |
| Analysetage | Montag-Donnerstag | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 2 Tage |
| Material | 1ml EDTA Blut | |
| Methode | Durchflusszytometrie; Oberflächenfärbung; Funktionstest | |
| Testbeschreibung | Bestimmung der Funktion des NADPH-Oxidase-Komplexes in Granulozyten nach Stimulation mit PMA mittels FACS Analyse | |
| Krankheitsbilder | CGD, IBD | |
| Kontrollblut | ja | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Vergleich mit Tageskontrolle | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 1ml Serum | |
| Methode | ELISA | |
| Testbeschreibung | Bestimmung der im Serum befindlichen Konzentration an löslichem Fas-Ligand mittels ELISA | |
| Krankheitsbilder | ALPS, AL-PID | |
| Kontrollblut | nein | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | Vitamin B12: altersabhängig vorhanden, siehe Befund sFasL: < 250 pg/ml | |
| Analysetage | sFasL: monatlich; Vitamin B12: täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |
| Material | 1ml Serum | |
| Methode | automatischer Random Access Immunoassay mittels Immulite 2000 XPi | |
| Testbeschreibung | Bestimmung der im Serum befindlichen Konzentration an löslichem IL-2 Rezeptor | |
| Krankheitsbilder | HLH | |
| Kontrollblut | nein | |
| Referenzbereich (bei Analyse von vorher gefrorenem Material ggf. abweichend, siehe Befund) | altersabhängig vorhanden siehe Befund | |
| Analysetage | täglich | |
| Bearbeitungszeit, Rückmeldung path. Ergebnisse | 1 Tag |