Modellvorhaben Genomsequenzierung nach § 64e SGB V
Erklärungen zur SOP für Ärzt*innen zum Einschluss von Patient*innen des UKF in das Modellvorhaben §64e Genomsequenzierung – Seltene Erkrankungen und Erbliche Tumorprädisposition
Sehr geehrte Kolleginnen und Kollegen,
mit diesem Schreiben möchten wir Sie gerne über das geplante Vorgehen für den Einschluss Ihrer Patient*innen zur Genomsequenzierung in das Modellvorhaben (MV) informieren.
Allgemeines: Im Rahmen des Gesundheitsversorgungsweiterentwicklungsgesetzes (GVWG) 2021 wurde in § 64e SGB V ein Modellvorhaben zur umfassenden Diagnostik und Therapiefindung mittels Genomsequenzierung sowohl bei seltenen Erkrankungen als auch bei onkologischen Erkrankungen beschlossen. Das Modellvorhaben (MV) startet nun und ab sofort können Personen mit Verdacht auf eine seltene Erkrankung, eine erbliche Tumorprädisposition oder eine onkologische Erkrankung mittels Genomsequenzierung untersucht werden. Die vorliegende Stellungnahme bezieht sich ausschließlich auf die Bereiche Seltene Erkrankungen (SE) und Erbliche Tumorprädisposition (ET), in denen es um die Identifizierung pathogener konstitutioneller Genveränderungen geht. Dies soll eine frühzeitige und spezifische Diagnose und damit eine individualisierte Therapie ermöglichen. Die Sequenzierung des Keimbahn-Genoms wird am Institut für Humangenetik durchgeführt.
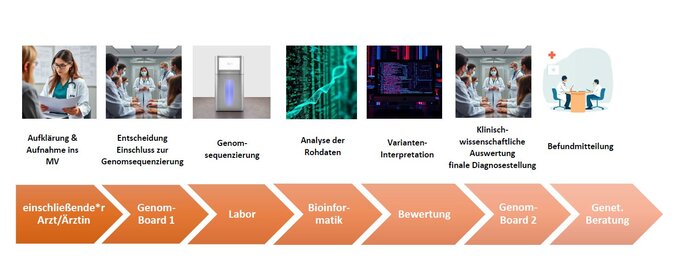
Praktischer Ablauf: Aufnahme von geeigneten Patient*innen in das Modellvorhaben durch die betreuenden Ärzt*innen aller Kliniken des UKF.
- Ab sofort können alle Ärzte aus allen Kliniken und Ambulanzen des UKF geeignete ambulante oder stationäre Patient*innen einschließen (siehe Details Seite 2).
- Zunächst müssen die Patient*innen zu einer interdisziplinären Fallkonferenz (Genom-Board 1) angemeldet werden, in der die Indikationsstellung geprüft werden muss.
- Bei positivem Beschluss des Genom-Boards 1 erfolgt innerhalb von 28 Tagen eine Genomsequenzierung (GWS) dieser Patient*innen am Institut für Humangenetik.
- Nach Abschluss der Sequenzierung erfolgt die bioinformatische Analyse und Interpretation der DNA-Veränderungen durch Mitarbeiter des Instituts für Humangenetik.
- In einer zweiten Fallkonferenz (Genom-Board 2) werden die Ergebnisse gemeinsam diskutiert, und im Zusammenhang mit den klinischen Daten der Patient*innen interpretiert.
- Am Ende erhält jede*r Patient*in einen humangenetischen Befund mit einer Beurteilung / ggf. Diagnose und Empfehlungen für das weitere Vorgehen.
Die erhobenen Daten dienen nicht nur der Verbesserung von Diagnostik und Therapie der Betroffenen, sondern auch der Überprüfung der Qualität der medizinischen Versorgung und damit der Evaluierung des MV. - Nicht zuletzt sollen die Daten auch in der wissenschaftlichen Genomforschung genutzt werden, um beispielsweise neue Zusammenhänge zwischen genetischen Veränderungen und der Entstehung von Krankheiten aufzudecken. Die einzelnen Schritte können Sie auch aus dem beigefügten Pfad entnehmen.
Welche Patient*innen können eingeschlossen werden?
- In das Projekt können in Deutschland krankenversicherte Patient*innen eingeschlossen werden, bei denen ein begründeter Verdacht auf eine genetische Ursache der Erkrankung besteht.
- Zu den Ausschlusskriterien gehört eine innerhalb der letzten 2 Jahre im Rahmen des Selektivvertrages durchgeführte Exomanalyse.
- Idealerweise stehen zusätzlich beide leiblichen Eltern für eine Trio-Genom-Analyse zur Verfügung. Eine Trio-Genom-Analyse ist für die Diagnosestellung oft unerlässlich, da unklare Veränderungen besser eingeordnet werden können und die Vererbung über Mutter und/oder Vater genau nachvollzogen werden kann.
SOP für Ärzt*innen zum Einschluss von Patient*innen des UKF in das Modellvorhaben §64e Genomsequenzierung – Seltene Erkrankungen und Erbliche Tumorprädisposition
Im Folgenden möchten wir schematisch darstellen, wann, wie und mit welchen Unterlagen ein Patient in das Modellvorhaben eingeschlossen werden kann und wie der Weg des Patienten durch die Studie aussieht.
Einschließende*r Arzt/Ärztin (alle ärztlichen Mitarbeiter des UKF)
1. Identifikation geeigneter Patient*innen durch den/die einschließende*n Arzt/Ärztin
- Identifizierung von Patient*innen mit Seltenen Erkrankungen (SE) oder erblicher Tumorprädisposition (ET) ohne genetische Diagnose
- Patient*in den Einschluss in das MV anbieten und Ablauf des MV erläutern (Fallkonferenzen, Genomsequenzierung, pseudonymisierter Datenaustausch)
2. Einwilligung des Patienten/der Patientin/Sorgeberechtigte*n in die Teilnahme
- Aufklärung durch den einschließenden Arzt und schriftliche Einverständnisse einholen für Patient*in und beide Eltern bei Minderjährigen (Trio-Genom)
- Teilnahmeerklärung (TE) MV
- MII Broad Consent (BC) (Patient*in und Eltern, bei Minderjährigen müssen beide Sorgeberechtigten einwilligen und unterschreiben)
- Einwilligung in genetische Diagnostik nach Gendiagnostikgesetz (GenDG MV)
(bei Minderjährigen von beiden Elternteilen unterschrieben) - Trio-Genom, wenn Eltern (potentiell) verfügbar: jeweils Index-Patient*in plus beide Eltern, dann auch Daten der Eltern unter Untersuchungsmaterial angeben (auch wenn Proben noch nicht vorliegen)
- Einzel-Genom, wenn Eltern nicht verfügbar
- Bei privat versicherten Patient*innen muss zusätzlich eine Krankenversicherungsnummer bei der PKV beantragt werden. Hierzu wurde ein Infoschreiben für PKV-Versicherte erstellt.
3. Probenentnahme durch den/die einschließende*n Arzt/Ärztin
- Probe (min. 2,7 ml EDTA Blut) von Patient*in und beiden Elternteilen
- Falls beide Elternteile bei Aufnahme in das MV nicht anwesend sind: Blutröhrchen (EDTA) und Einwilligung nach Gendiagnostikgesetz (GenDG) mitgeben und telefonische Aufklärung anbieten, oder Blutentnahmetermin vereinbaren (bei Minderjährigen müssen beide Sorgeberechtigten die TE, MII-BC und Einwilligung nach GenDG des Kindes unterschreiben)
4. Probenversand durch den/die einschließende*n Arzt/Ärztin
- EDTA-Blut und alle unter Punkt 2. erwähnten Unterlagen (TE MV, MII BC, Anforderung und Einwilligung nach Gendiagnostikgesetz (GenDG), und weitere aussagekräftige Arztbriefe) per Hauspost/Email verschicken an:
Institut für Humangenetik - Probeneingang
Breisacher Str. 33, 79106 Freiburg
Nach der Pilotphase können die 3 Einverständniserklärungen digital erfasst werden.
5. Anmeldung zur Genomsequenzierung MV durch den/die einschließende*n Arzt/Ärztin
- Anmeldung bei der Koordinationsstelle MV des Instituts für Humangenetik
Nach der Pilotphase: Roxtra: Anforderung à Humangenetik à Anmeldung Genom - Dokumentation der klinischen Daten der Patient*innen durch den/die einschließende*n Arzt/Ärztin in CalliDoc, zu Beginn über eine Excel-Tabelle (10 Felder).
6. Teilnahme am interdisziplinär dokumentierten Genom-Board 1
- Fallbesprechung vor der Genomsequenzierung, einschließende*r Arzt/Ärztin/Abteilung werden hierfür von der Humangenetik eingeladen.
7. Teilnahme am Genom-Board 2
- Diskussion der Ergebnisse der Genomsequenzierung und daraus folgendem Management, einschließende*r Arzt/Ärztin/Abteilung werden hierfür in einer ersten Phase von der Koordination Humangenetik eingeladen (bis IKOS funktioniert).
8. Befundmitteilung und Mitteilung Beschluss Genom-Board 2 an den Patienten
- Dokumentation in einem Arztbrief, Angebot zur humangenetischen Beratung
- Patienteninformation und Teilnahmeerklärung zum „Modellvorhaben Genomsequenzierung bei seltenen und bei onkologischen Erkrankungen“
- Anforderung einer Genomsequenzierung (WGS) und Einwilligung nach dem GenDG
- Patienteninformation zur Nutzung von Patientendaten, Krankenkassendaten und Biomaterialien (Gewebe und Körperflüssigkeiten) für medizinische Forschungszwecke
- Bereitstellung einer Krankenversicherungsnummer für das Modellvorhaben Genomsequenzierung
SOP Modellvorhaben Seltene Erkrankungen und Erbliche Tumorprädisposition