Bioinstrumentation / Experimentelle Bildgebung
Die Sektion Bioinstrumentation / Experimentelle Bildgebung entwickelt spezialisierte Apparaturen für die kardiovaskuläre Forschung, welche benötigt werden, da innovative Forschungsfragen oft nicht mit kommerziell erhältlichen Gerätschaften beantwortet werden können. Zu diesem Zweck betreiben wir Prototypentwicklung von mechanischen und elektrischen Komponenten, basierend auf Expertise in Sensorik, Imaging-Techniken, Signalprozessierung, Kontrollsystemen, sowie Benutzeroberflächen.
Optoakustische Bildgebung
Derzeit gibt es keine Möglichkeit, die elektrische Aktivität im Herzen in 3D abzubilden, ohne dabei das Gewebe zu schädigen. Die optoakustische Bildgebung ist ein Verfahren, bei dem Laserpulse zur Anregung von bestimmten Molekülen verwendet werden. Dabei wird die Laserenergie von den Molekülen absorbiert, was zu einer thermoelastischen Ausdehnung von Chromophoren mit dem Gewebe und anschließend zur Erzeugung einer Druckwelle führt, die mit Ultraschall aufgezeich- net werden kann. Mittels Tomographie können die genauen Positionen der Chromophore im Gewebe ermittelt werden. Das optoakustische Bildgebungs- verfahren vereint die Vorteile der Fluoreszensbildgebung mit der Eindringtiefe des Ultraschalls kombiniert, und ermöglicht somit eine 3D-Messung der kardialen Elektrophysiologie. In Zusammenarbeit mit Partnern in Großbritannien, USA, Schweiz und Deutschland testen wir derzeit spannungssensitive Farbstoffe und optoakustische Bildgebungssysteme auf ihre Eignung für solche 3D-Messungen.
Optical Mapping
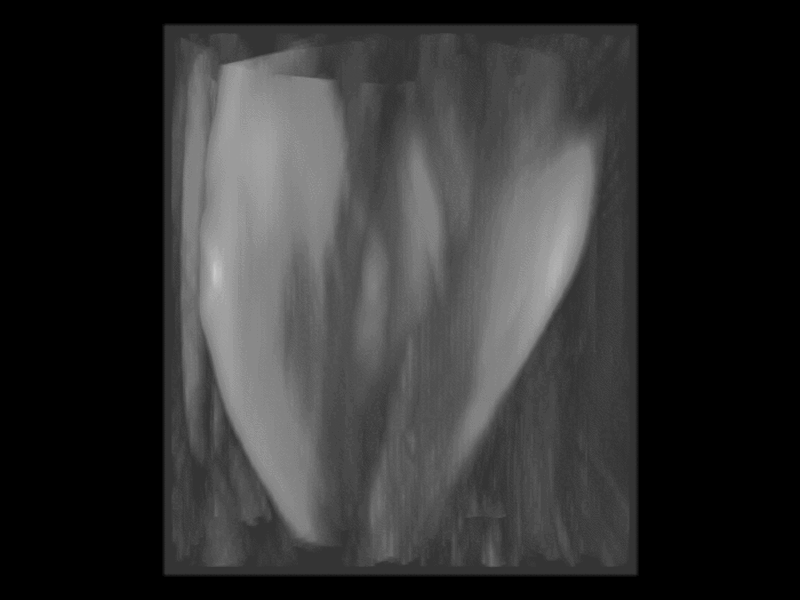
Im Kontrast zur vielversprechenden optoakustischen Bildgebung, ist das Optical Mapping eine etablierte Methode, die es ermöglicht, Veränderungen der Zelleigenschaften (wie Membranspannung und Ionenkonzentration) bei hoher räumlicher und zeitlicher Auflösung zu messen, allerdings mit der Einschränkung, diese nur nahe der Oberfläche des Gewebes detektieren zu können. Wir haben kürzlich ein Panoramabildgebungssystem entwickelt, mit dem wir mithilfe von Spiegeln die Oberfläche ganzer Herzen mit einer einzigen Kamera abbilden können. Dieses System wird derzeit weiterentwickelt, um aufgenommene oberflächliche elektrische Reizleitung mithilfe von Lichtscheibenmikroskopie mit auf darunterliegende Gewebestrukturen abbilden zu können. Das Optical Mapping kommt in einer Reihe von Projekten zur Anwendung, unter anderem bei der Erforschung des Auslösers von Arrhythmien nach Reperfusionsschäden, oder der Erforschung Rolle des Nervensystems im Herzen bei der Bildung von Arrhythmien.
Abb. 2: Panoramabildgebungssystem zur optischen Abbildung von Membran- spannung und Kalzium bei gleichzeitiger Messung der Mechanik mit Ultraschall.
Kardiale Stimulation
Wir können das Optical Mapping auch mit Werkzeugen zur optischen Kontrolle von Zellfunktionen kombinieren, z.B. via Licht-aktivierten Ionenpumpen und Kanälen. Solch ein kombinierter Aufbau ermöglicht somit vollkommen Licht-kontrollierte Untersuchungen kardiovaskulärer Funktionen von gesunden und krankheitsbedingt veränderten Proben. Ein Beispiel für solch eine Verwendung ist die optische Stimulation, bei der ein Herzschlag durch Bestrahlung mit Licht angeregt wird, anstatt durch einen elektrischen Strom (wie bei heutigen Herzschrittmachern üblich). Prinzipiell ist jedes Verfahren, das zu einem ausreichend großen Stromfluss in eine bestimmte Anzahl von Herzzellen führt, ausreichend, um einen Herzschlag zu beschleunigen. Interessanterweise können über dehnungs- aktivierte Kanäle im Herzen ähnliche Ströme hervorgerufen werden, d.h. ein Herzschlag kann durch bloßes Antippen beschleunigt werden. Dies ist besonders interessant für Notfallsituationen einer primären Asystole, wenn das Herz also nicht mehr schlägt und eine Herzmassage die beste verfügbare Option ist. Das erzeugbare Herzschlagvolumen ist jedoch relativ gering, so dass die Fähigkeit, das Herz durch einfaches Klopfen auf die Brust wieder zu beschleunigen, äußerst attraktiv erscheint. In ersten Experimenten konnte jedoch gezeigt werden, dass nach 50-100 Schlägen die mechanische Stimulierbarkeit abnimmt (Quinn et al., 2016). Um zu untersuchen, wie und warum dies geschieht, haben wir in Zusammenarbeit mit der Technischen Fakultät (IMTEK) ein System entwickelt, bei dem wir elektrische, mechanische und optische Stimulation an der exakt gleichen Stelle des Herzens anwenden und schnell zwischen den einzelnen Stimuli wechseln können.
Fig. 3: Spitze einer Optrodensonde bestehend aus einer 270 μm x 270 μm x 270 μm LED in der Mitte, umgeben von Elektroden.
-
Zhang HK, Yan P, Kang J, Abou DS, Le HN, Jha AK, Thorek DL, Kang JU, Rahmim A, Wong DF, Boctor EM, Loew LM. Listening to membrane potential: photoacoustic voltage-sensitive dye recording. J Biomed Opt 2017/22(4):45006
-
Becker C, Hardarson J, Hoelzer A, Schulz T, Reichl C, Burton NC, Schuler T, Kohl P, Zgierski-Johnston C. Evaluation of cervical lymph nodes using multispectral optoacoustic tomography: a proof-of-concept study. Eur Arch Otorhinolaryngol 2023/280:4657-64
-
Lee P, Yan P, Ewart P, Kohl P, Loew LM, Bollensdorff C. Simultaneous measurement and modulation of multiple physiological parameters in the isolated heart using optical techniques. Pflugers Arch 2012/464:403–14
-
Johnston CM, Rog-Zielinska EA, Wülfers EM, Houwaart T, Siedlecka U, Naumann A, Nitschke R, Knöpfel T, Kohl P, Schneider-Warme F. Optogenetic targeting of cardiac myocytes and non-myocytes: Tools, challenges and utility. Prog Biophys Mol Biol 2017/130:140-149
-
Sassu E, Tumlinson G, Stefanovska D, Fernández MC, Iaconianni P, Madl J, Brennan TA, Koch M, Cameron BA, Preissl S, Ravens U, Schneider-Warme F, Kohl P, Zgierski-Johnston CM, Hortells L. Age-related structural and functional changes of the intracardiac nervous system. J Mol Cell Cardiol. 2023 187:1-14
-
Quinn TA, Kohl P. Comparing maximum rate and sustainability of pacing by mechanical vs. electrical stimulation in the Langendorff-perfused rabbit heart. Europace 2016/18(suppl 4):iv85-iv93
-
Lewetag RD, Nimani S, Alerni N, Hornyik T, Jacobi SF, Moss R, Menza M, Pilia N, Walz TP, HajiRassouliha A, Perez-Feliz S, Zehender M, Seemann G, Zgierski-Johnston CM, Lopez R, Odening KE. Mechano-electrical interactions and heterogeneities in wild-type and drug-induced long QT syndrome rabbits. J Physiol. 2023/Epub ahead of print.
-
Kohl P, Zgierski-Johnston CM. Assessment of Tissue Viability by Functional Imaging of Membrane Potential. Methods Mol Biol. 2023/2644:423-34
-
Han B, Trew M, Zgierski-Johnston CM. Cardiac Conduction Velocity, Remodeling and Arrhythmogenesis. Cells 2021/10:2923
-
Zgierski-Johnston CM, Ayub S, Fernández MC, Rog-Zielinska EA, Barz F, Paul O, Kohl P, Ruther P. Cardiac pacing using transmural multi-LED probes in channelrhodopsin-expressing mouse hearts. Prog Biophys Mol Biol 2020/154:51-61
Team

Dr. Callum Zgierski-Johnston
Arbeitsgruppenleiter

Leonardo Sacconi, PhD
Senior Scientist

Dr. Francesco Giardini

Jana Ebeling

Gyuwon Lee
E-Mail: gyuwon.lee@uniklinik-freiburg.de

E-Mail: bo.han@uniklinik-freiburg.de

Anna-Lena Herm

Thomas Kok
E-Mail: thomas.kok@uniklinik-freiburg.de

Dr. Tony Rubio
E-Mail: tony.rubio@uniklinik-freiburg.de

Collin Snitchler