Multimodale Biomarker für Neurodegeneration
Multimodale Biomarker für NeurodegenerationMission
Neurodegenerative Erkrankungen gewinnen durch den demographischen Wandel zunehmend an Bedeutung. Um Therapiemaßnahmen gezielt anwenden zu können, ist ein tiefgreifendes Verständnis der Pathophysiologie und auch eine präzise Diagnosestellung notwendig. Moderne Biomarker können essentiell hierzu beitragen, müssen jedoch vor der Etablierung in der klinischen Routine entwickelt und validiert werden.
- Pathophysiologie verstehen: Grundlage jedes diagnostischen und therapeutischen Ansatzes einer Erkrankung ist es zunächst, die Pathophysiologie zu verstehen. Durch die interdisziplinäre Etablierung fortschrittlicher Biomarker und moderner Auswerteverfahren werden tiefere Einblicke in die Pathomechanismen bei neurodegenerativer Erkrankungen möglich.
- Diagnose und Prognostizierung verbessern: Die Diagnosestellung kann durch die multimodale Integration verschiedener klinischer, laborchemischer und bildgebender Parameter erheblich verbessert werden. Gleichzeitig soll auch die Wertigkeit der Zusammenschau dieser Parameter zur Prognoseabschätzung evaluiert werden.
- Individualisierte Therapieentscheidungen fördern: Durch die Entwicklung von objektiven Biomarkern soll eine individuelle Vorhersage des Therapieansprechens möglich werden.
Hintergrund
- Neurodegenerative Erkrankungen wie Demenzen und Parkinson-Syndrome sind weltweit auf dem Vormarsch. Die klinische Diagnose dieser Erkrankungen ist auf Grund von syndromalen Überschneidungen oft fehleranfällig was im Hinblick auf pathologiespezifische Therapien ein zunehmendes Problem darstellt. Daher wird zunehmend das Ziel einer biologischen Definition der Erkrankungen verfolgt.
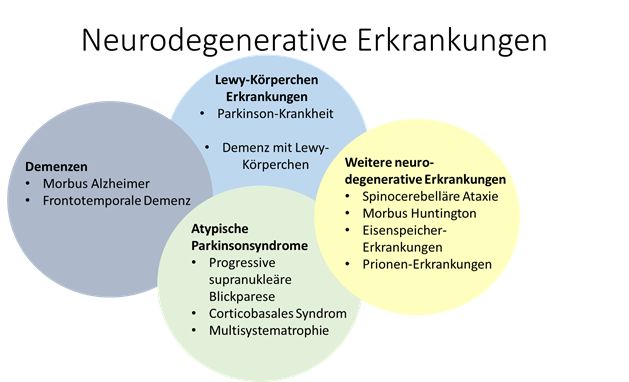
Nach McFarland 2016, Continuum und Elahi et al. 2017, Nature Reviews Neurology
- Moderne Bildgebung kann die Lücke zwischen dem klinischen Syndrom und der zugrundeliegenden Pathologie verkleinern, indem sie detaillierte Einblicke in strukturelle und funktionelle Veränderungen im Gehirn bietet. Sie leistet somit einen erheblichen Beitrag zur biologischen Definition neurodegenerativer Erkrankungen.
- Moderne Bildgebung ermöglicht nicht nur die Diagnose, sondern kann ebenso als Progressionsmarker dienen, indem sie die Neurodegeneration im Gehirn im Laufe der Zeit quantifiziert.
- Die moderne Bildgebung bietet ein tiefergehendes Verständnis der zugrundeliegenden pathophysiologischen Veränderungen in-vivo und ermöglicht so (a) die Identifizierung potenzieller Biomarker für individualisierte Therapieentscheidungen und (b) die Entwicklung neuer, translationaler Therapieansätze.
- Veränderungen in der Bildgebung können den klinischen Symptomen vorausgehen, sodass bereits vor Manifestation der Erkrankung therapeutische Maßnahmen getroffen werden könnten, bzw. dies zur Identifikation von Risikokonstellationen genutzt werden kann.
Forschungsschwerpunkte
Quantifizierung der Neurodegeneration in-vivo mittels moderner MRT-Techniken
Als modernes Imaging-Lab haben wir uns auf den Einsatz fortschrittlicher Bildgebungsverfahren sowie moderner Auswertemethoden spezialisiert. So setzen wir unter anderem Volumetrie, Morphometrie, Diffusion-Tensor-Imaging (DTI), Diffusions-Mikrostruktur-Bildgebung (DMI), Neurite Orientation Dispersion and Density Imaging (NODDI) und Arterial-Spin-Labelling (ASL) ein.
Als modernes Imaging-Lab haben wir uns auf den Einsatz fortschrittlicher Bildgebungsverfahren sowie moderner Auswertemethoden spezialisiert. So setzen wir unter anderem Volumetrie, Morphometrie, Diffusion-Tensor-Imaging (DTI), Diffusions-Mikrostruktur-Bildgebung (DMI), Neurite Orientation Dispersion and Density Imaging (NODDI) und Arterial-Spin-Labelling (ASL) ein.
Volumetrische Bestimmung zerebraler Atrophie
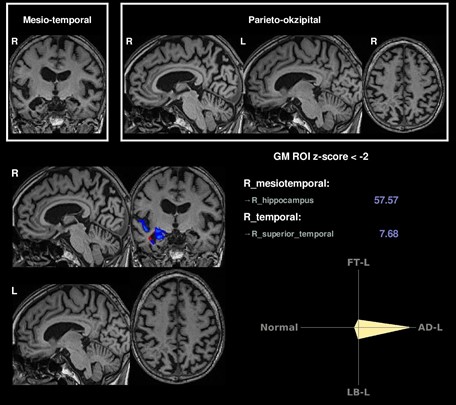
Beispiel einer einfachen KI-Analyse, die Voxel-basiert einen einzelnen Patienten mit einer Kontrollgruppe vergleicht und hierbei das Atrophiemuster (rechts temporomesial betont) korrekt einer Alzheimer-Demenz („AD-L“ im Kompass) zuordnet. In der oberen Reihe sind hierbei exemplarische Schichtungen dargestellt, während unten links die Atrophie farblich hervorgehoben wird.
Die klinischen Symptome neurodegenerativer Erkrankungen werden von einer Atrophie in erkrankungstypischen Regionen des Gehirns begleitet. Diese Veränderungen können mittels MRT volumetrisch bestimmt werden, was eine präzise Quantifizierung der Hirnatrophie ermöglicht. Hierdurch wird die Diagnosestellung in der klinischen Routine erheblich verbessert (https://www.veobrain.com/?page=veomorph).
Diffusions-Mikrostruktur-Bildgebung (DMI) in der MRT
Durch die Diffusions-Mikrostruktur-Bildgebung kann die zerebrale Mikrostruktur ohne die Applikation von Strahlung oder Kontrastmittel approximiert werden. Diese Methode ermöglicht eine präzise Quantifizierung der Neurodegeneration und liefert wertvolle Informationen über mikroskopische Veränderungen im Gehirn von Patient*innen mit einer neurodegenerativen Erkrankung.
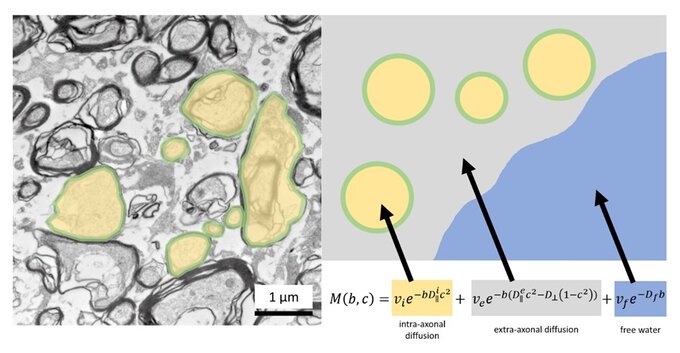
Prinzip der Diffusions-Mikrostruktur-Bildgebung. Links ist eine Elektronenmikroskop-Aufnahme der weißen Substanz abgebildet. Rechts sind schematisch die durch DMI erfassten Kompartimente dargestellt: die intraaxonale Fraktion in Gelb, die extraaxonale Fraktion in Grau und das Liquorkompartiment in Blau. Nach Demerath et al. 2022 Cerebral Cortex
Arterial-Spin-Labelling (ASL) in der MRT
Durch das Arterial-Spin-Labelling (ASL) wird die zerebrale Perfusion ohne die Verwendung von Kontrastmittel gemessen. Diese Technik ermöglicht eine Quantifizierung des zerebralen Blutflusses und liefert so neben Informationen über die Vaskularisation insbesondere auch indirekt Informationen über die Aktivität und funktionelle Integrität des Gehirns.
Verarbeitungstechniken:
Validierung der Erkrankungs-spezifischen Bildmuster Zur Validierung erkrankungsspezifischer Bildmuster wird jeweils eine Kohorte mit einer neurodegenerativen Erkrankung, z.B. der Alzheimer-Demenz oder oder Parkinson-Krankheit, mit einer gesunden, alters- und geschlechtsgematchten Kontrollgruppe verglichen. Dabei kommen verschiedene Analyseverfahren zum Einsatz, um die charakteristischen Bildmuster der Erkrankungen zu beschreiben.
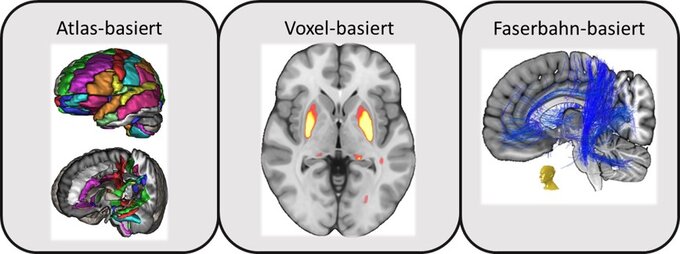
a.) Atlas-basierter Ansatz: Im Atlas-basierten Ansatz werden Gehirnatlanten verwendet, um das Hirngewebe in anatomische respektive funktionelle Regionen zu unterteilen..
b.) Voxel-basierter Ansatz: Da Informationen durch die sog. Parzellierung, also Unterteilung, im Atlas-basierten Ansatz verloren gehen können, wird das Erkrankungs-spezifische Bildmuster neurodegenerativer Erkrankungen auch mittels Voxel-basierter Analysen beschrieben. Hierbei werden statistische Vergleiche der quantitativen Parameter durchgeführt, um Voxel zu identifizieren, die sich signifikant zwischen Erkrankten und Gesunden unterscheiden.
c.) Streamline-basierter Ansatz: Die statistische Auswertung von Zusammenhängen mit neuroanatomischen Veränderungen erfolgt typischerweise auf der Ebene einzelner Bildpunkte, sogenannter Voxel. Diese Voxel stellen jedoch eine künstliche Unterteilung dar, die kein direktes neuroanatomisches Korrelat besitzen. Streamlines können vereinfacht als Äquivalente von Nervenfasern betrachtet werden. Dadurch wird es möglich, pathologische Veränderungen der zerebralen Mikrostruktur sichtbar zu machen und die beteiligten Netzwerke zu entschlüsseln.
Entschlüsselung der Rolle des Plexus choroideus bei Neurodegeneration
Inflammation wird zunehmend als weiterer Pathomechanismus in der Entstehung und Aufrechterhaltung neurodegenerativer Erkrankungen beobachtet. Im Rahmen von Entzündungen kommt es zu einer Vergrößerung des Plexus choroideus, die mittels MRT quantifiziert werden kann. Somit können über diese Methode ohne den Einsatz von Kontrastmittel neue Erkenntnisse über Neuroinflammation in-vivo gewonnen werden.
Integration klinischer Parameter und Biomarker durch Ansätze künstlicher Intelligenz
Durch den Einsatz moderner Machine Learning Techniken können Bildgebungsdaten mit klinischen Parametern und Biomarkern aus anderen Modalitäten zusammengeführt werden. Somit ist die Erkennung auch komplexer Muster und Zusammenhänge möglich.
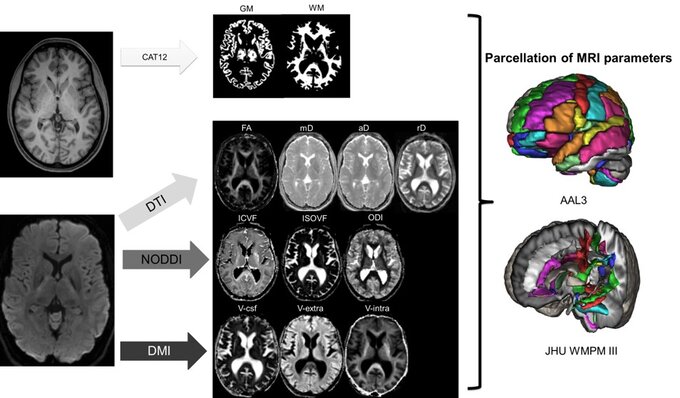
Beispielhafter Aufbau einer multiparametrischen MRT-Analyse. Die in diesem Schritt gewonnen Werte werden mittels künstlicher Intelligenz analysiert. Nach Schröter et al. 2024 Clinical Neuroradiology.
Freiburger Register für Parkinson-Syndrome und Demenzen (FreePD)
Der Aufbau des longitudinalen Freiburger Registers für Parkinson-Syndrome und Demenzen ermöglicht ein tiefgehendes Verständnis des individuellen Verlaufs neurodegenerativer Erkrankungen. Durch die langfristige Erfassung von Patientendaten werden wichtige Erkenntnisse über pathophysiologische Zusammenhänge gewonnen und Biomarker für Erkrankungsprogression, Prognose sowie für die Prädiktion des individuellen Therapieansprechens entwickelt.
Integration von Populationsdaten
Durch die Analyse großer Datensätze können populationsbezogene Risikofaktoren für den Ausbruch und die Progredienz neurodegenerativer Erkrankungen identifiziert werden, die auf individueller Ebene oft nicht quantifizierbar sind.
Arbeitsgruppenleitung
Dr. Alexander Rau Klinik für Neuroradiologie | Dr. Nils Schröter Klinik für Neurologie und Neurophysiologie |
| Mitarbeitende der AG | Position |
| Lea Philipsen | Assistenzärztin |
| Araz Incesoy | Assistenzärztin |
| Sabine Ahrendt | Parkinson Nurse |
| Gerit Kammel | Study Nurse |
| Danielle Bunk | Medizinische Doktorandin |
| Laura Matinpalo | Medizinische Doktorandin |
| Anna Patricia Müller-Glaw | Medizinische Doktorandin |
| Ann-Kathrin Frick | Medizinische Doktorandin |
| Melina Maier | Medizinische Doktorandin |
| Lucas Both | Medizinischer Doktorand |
| Prof. Dr. Horst Urbach | Senior Researcher |
| Prof. Dr. Michel Rijntjes | Senior Researcher |
| Ehemalige: | Dr. med. Valentin Friedmann |
Es besteht die Möglichkeit, medizinische Doktorarbeiten in unserer Arbeitsgruppe zu verfassen. Bei Interesse wenden Sie sich bitte an die beiden Leiter der Arbeitsgruppe.
Kooperationen - Universitätsklinikum Freiburg
Klinik für Nuklearmedizin: Prof. Dr. Dr. Philipp T. Meyer, Dr. Lars Frings, Dr. Joachim Brumberg
AG Experimentelle Neurorehabilitation, Klinik für Neurologie und klinische Neurowissenschaften: Prof. Dr. Jonas A. Hosp
Klinik für Psychiatrie und Psychotherapie: Prof. Dr. Sabine Hellwig
Abteilung Stereotaktische und Funktionelle Neurochirurgie der Klinik für Neurochirurgie: Prof. Dr. Volker A. Coenen, Dr. Bastian E.A. Sajonz
Abteilung für Medizinphysik der Klinik für Radiologie: Dr. Marco Reisert, Dr. Elias Kellner
Klinik für Diagnostische und Interventionelle Radiologie: Dr. Maximilian Russe, Dr. Philipp Arnold
Kooperationen – Deutschland
Parkinson-Klinik Ortenau: Prof. Dr. Wolfgang H. Jost, Dr. Pantelis Oikonomou, Dr. Emir Berberovic
Klinik und Poliklinik für Neurologie, Universitätsklinikum Mainz: Prof. Dr. Sergiu Groppa
Klinik für Neurologie, Katholisches Klinikum Bochum, Universitätsklinikum der Ruhr-Universität Bochum: Prof. Dr. Lars Tönges.
Klinik für Diagnostische und Interventionelle Radiologie, Universitätsklinikum Ulm: Dr. Nico Sollmann
Klinik für Neurologie, Universitätsklinikum Ulm: Prof. Jan Kassubek
Funding
Publikationen
Joachim Brumberg, Ganna Blazhenets, Sabrina Bühler, Johannes Fostitsch, Michel Rijntjes, Yilong Ma, David Eidelberg, Cornelius Weiller, Wolfgang H. Jost, Lars Frings, Nils Schröter*, und Philipp T. Meyer*. „Cerebral glucose metabolism is a valuable predictor of survival in patients with Lewy body diseases“. Annals of Neurology (2024) – im Druck.
Marco G Hermann*, Nils Schröter*, Alexander Rau*, Marco Reisert, Nadia Jarc, Michel Rijntjes, Jonas A. Hosp, Peter C. Reinacher, Wolfgang H. Jost, Horst Urbach, Cornelius Weiller, Volker A. Coenen, Beastian E.A. Sajonz. „The connection of motor improvement after deep brain stimulation in Parkinson's disease and microstructural integrity of the substantia nigra and subthalamic nucleus.“ NeuroImage-Clinical (2024). doi.org 10.1016/j.nicl.2024.103607.
Alexander Rau, Jonas A Hosp, Michel Rijntjes, Cornelius Weiller, Elias Kellner, Emir Berberovic, Panteleimon Oikonomou, Wolfgang H Jost, Marco Reisert, Horst Urbach, und Nils Schröter. „Cerebellar, Not Nigrostriatal Degeneration Impairs Dexterity in Multiple System Atrophy“. Movement Disorders (2024). 39, Nr. 1: 130–40. doi.org/10.1002/mds.29661.
Nils Schröter*, Philipp G. Arnold*, Jonas A. Hosp, Marco Reisert, Michel Rijntjes, Elias Kellner, Wolfgang H. Jost, Cornelius Weiller, Horst Urbach, und Alexander Rau. „Complemental Value of Microstructural and Macrostructural MRI in the Discrimination of Neurodegenerative Parkinson Syndromes“. Clinical Neuroradiology (2024). doi.org/10.1007/s00062-023-01377-w.
Nils Schröter, Bastian E. A. Sajonz, Wolfgang H. Jost, Michel Rijntjes, Volker A. Coenen, und Sergiu Groppa. „Advanced Therapies in Parkinson’s Disease: An Individualized Approach to Their Indication“. Journal of Neural Transmission (2024). doi.org/10.1007/s00702-024-02773-3.
Dominik Pürner, Mohammad Hormozi, Daniel Weiß, Michael T Barbe, Hannah Jergas, Tino Prell, Eileen Gülke, Monika Pötter-Nerger, Björn Falkenburger, Lisa Klingelhöfer, Pia K Gutsmiedl, Bernhard Haslinger , Angela M Jochim , Andreas Wolff , Nils Schröter , Michel Rijntjes , Christoph van Riesen , Ute Scheller , Martin Wolz , Ali Amouzandeh , Georg Ebersbach et al.. „Nationwide Retrospective Analysis of Combinations of Advanced Therapies in Patients with Parkinson Disease“. Neurology (2023) 101, Nr. 21: e2078–93. doi.org/10.1212/WNL.0000000000207858.
Alexander Rau, Nils Schröter, Ganna Blazhenets, Christoph Maurer, Horst Urbach, Philipp T. Meyer, und Lars Frings. „The Metabolic Spatial Covariance Pattern of Definite Idiopathic Normal Pressure Hydrocephalus: An FDG PET Study with Principal Components Analysis“. Alzheimer’s Research & Therapy (2023) 15, Nr. 1: 202. doi.org/10.1186/s13195-023-01339-x.
Alexander Rau, Nils Schröter, Michel Rijntjes, Fabian Bamberg, Wolfgang H Jost, Maxim Zaitsev , Cornelius Weiller , Stephan Rau, Horst Urbach, Marco Reisert, und Maximilian F Russe „Deep Learning Segmentation Results in Precise Delineation of the Putamen in Multiple System Atrophy“. European Radiology (2023) 33, Nr. 10: 7160–67. doi.org/10.1007/s00330-023-09665-2.
Nils Schröter, Thilo van Eimeren, Joseph Classen, Johannes Levin, Christoph Redecker, Martin Wolz, und Lars Tönges. „Significance of Clinical Symptoms and Red Flags in Early Differential Diagnosis of Parkinson’s Disease and Atypical Parkinsonian Syndromes“. (2023) Journal of Neural Transmission 130, Nr. 6: 839–46. doi.org/10.1007/s00702-023-02634-5.
Nils Schröter, Ganna Blazhenets, Philipp T. Meyer, Michel Rijntjes, und Joachim Brumberg. „[18F]PM-PBB3-PET Reveals Clinical and [18F]FDG-PET Mimics of 4-Repeat Tauopathy Caused by Creutzfeld-Jakob Disease“. Movement Disorders Clinical Practice (2023) 10, Nr. 3: 531–32. doi.org/10.1002/mdc3.13683.
Nils Schröter, Tobias Bormann, Michel Rijntjes, Ganna Blazhenets, Raissa Berti, Bastian E.A. Sajonz, Horst Urbach, Cornelius Weiller, Philipp T. Meyer, Alexander Rau*, und Lars Frings*. „Cognitive Deficits in Parkinson’s Disease Are Associated with Neuronal Dysfunction and Not White Matter Lesions“. Movement Disorders Clinical Practice (2023) 10, Nr. 7: 1066–73. doi.org/10.1002/mdc3.13792.
Alexander Rau, Wolfgang H. Jost, Theo Demerath, Elias Kellner, Marco Reisert, Horst Urbach. Diffusion microstructure imaging in progressive supranuclear palsy: reduced axonal volumes in the superior cerebellar peduncles, dentato-rubro-thalamic tracts, ventromedial thalami, and frontomesial white matter. Cereb Cortex. 2022 Dec 8;32(24):5628-5636. doi: 10.1093/cercor/bhac041.
Nils Schröter, Ganna Blazhenets, Lars Frings, Wolfgang H. Jost, Cornelius Weiller, Michel Rijntjes, Philipp T. Meyer, und Joachim Brumberg. „Nigral Glucose Metabolism as a Diagnostic Marker of Neurodegenerative Parkinsonian Syndromes“. Npj Parkinson’s Disease (2022): 8, Nr. 1 1–7. doi.org/10.1038/s41531-022-00392-x.
Nils Schröter, Michel Rijntjes, Horst Urbach, Cornelius Weiller, Martin Treppner, Elias Kellner, Wolfgang H. Jost, Bastian E. A. Sajonz, Marco Reisert, Jonas A. Hosp und Alexander Rau. „Disentangling Nigral and Putaminal Contribution to Motor Impairment and Levodopa Response in Parkinson’s Disease“. Npj Parkinson’s Disease (2022) 8, Nr. 1: 1–8. doi.org/10.1038/s41531-022-00401-z.
Nils Schröter, Anna Hager, Alexander Rau, Horst Urbach, Volker A. Coenen, und Michel Rijntjes. „Acute Head- and Gaze Deviation, Facial Asymmetry and Anarthria Mimicking Stroke, Caused by Short Circuit in Deep Brain Stimulation“ (2022). Brain Stimulation 15, Nr. 1: 257–59. doi.org/10.1016/j.brs.2022.01.003.
Alexander Rau, Horst Urbach. The MTA score-simple and reliable, the best for now? Eur Radiol. 2021 Dec;31(12):9057-9059. doi: 10.1007/s00330-021-08340-8.
Alexander Rau, Marco Reisert, Elias Kellner, Jonas A. Hosp, Horst Urbach, Theo Demerath. Increased interstitial fluid in periventricular and deep white matter hyperintensities in patients with suspected idiopathic normal pressure hydrocephalus. Sci Rep. 2021 Oct 1;11(1):19552. doi: 10.1038/s41598-021-98054-0.
Alexander Rau, Jiri Koschel, Karl Egger, Wolfgang H. Jost. The final diagnoses of patients with clinically suspected atypical parkinsonian syndromes. Parkinsonism Relat Disord. 2021 Apr;85:57-58. doi: 10.1016/j.parkreldis.2021.
Alexander Rau, Suam Kim, Shan Yang, Marco Reisert, Elias Kellner, Ikram Duman, Bram Stieltjes, Marc Hohenhaus, Jürgen Beck, Horst Urbach, Karl Egger. SVM-Based Normal Pressure Hydrocephalus Detection. Clin Neuroradiol. 2021 Dec;31(4):1029-1035. doi: 10.1007/s00062-020-00993-0.
Alexander Rau, Wolfgang H. Jost, Rieka von der Warth, Horst Urbach. Experience with a New Index to Differentiate Parkinson's Disease and Progressive Supranuclear Palsy. Mov Disord. 2021 Sep;36(9):2207-2208. doi: 10.1002/mds.28721.
Joachim Brumberg*, Nils Schröter*, Ganna Blazhenets, Lars Frings, Jens Volkmann, Constantin Lapa, Wolfgang H. Jost, Ioannis U. Isaias, und Philipp T. Meyer. „Differential Diagnosis of Parkinsonism: A Head-to-Head Comparison of FDG PET and MIBG Scintigraphy“. Npj Parkinson’s Disease (2020) 6, Nr. 1: 1–7. doi.org/10.1038/s41531-020-00141-y.
Nils Schröter, Ganna Blazhenets, Lars Frings, Christoph Barkhausen, Wolfgang H. Jost, Cornelius Weiller, Michel Rijntjes, und Philipp T. Meyer. „Tau Imaging in the 4-Repeat-Tauopathies Progressive Supranuclear Palsy and Corticobasal Syndrome: A 11C-Pyridinyl-Butadienyl-Benzothiazole 3 PET Pilot Study“. Clinical Nuclear Medicine (2020) 45, Nr. 4: 283–87. doi.org/10.1097/RLU.0000000000002949.
Karl Egger, Alexander Rau, Shan Yang, Stefan Klöppel, Ahmed Abdulkadir, Elias Kellner, Lars Frings, Sabine Hellwig, Horst Urbach; Alzheimer's Disease Neuroimaging Initiative. Automated voxel- and region-based analysis of gray matter and cerebrospinal fluid space in primary dementia disorders. Brain Res. 2020 Jul 15;1739:146800. doi: 10.1016/j.brainres.2020.146800.
Nils Schröter, Sabine Ahrendt, Anna Hager, und Michel Rijntjes. „Addition of Tolcapone in Intrajejunal Levodopa Infusion Therapy Requires a Pronounced Dose Reduction“. Movement Disorders Clinical Practice (2020) 7, Nr. 7: 854–56. doi.org/10.1002/mdc3.13029.
Konrad Whittacker, Nils Schröter, Michel Rijntjes, Konstanze Guggenberger, Johann Lambeck, Brita Fritsch, Cornelius Weiller, Philipp T. Meyer, Soroush Doostkam, und Stephan Klebe. „Severe Camptocormia Due to Myositis of Paraspinal Muscles as an Early Manifestation of Parkinson’s Disease“. Parkinsonism & Related Disorders (2018). 46: 95–97. doi.org/10.1016/j.parkreldis.2017.11.008.
Anwendung der entwickelten Techniken in Kooperation mit anderen Arbeitsgruppen:
Jonas A. Hosp*, Marco Reisert*, Andrea Dressing, Veronika Götz, Elias Kellner, Hansjörg Mast, Susan Arndt, Cornelius Waller, Dirk Wagner, Siegbert Rieg, Horst Urbach, Cornelius Weiller, Nils Schröter*, Alexander Rau*. „Cerebral Microstructural Alterations in Post-COVID-Condition Are Related to Cognitive Impairment, Olfactory Dysfunction and Fatigue“. Nature Communications (2024). 15, Nr.1, 4256. doi.org/10.1038/s41467-024-48651-0.
Alexander Rau; Gabriel Gonzalez-Escamilla, Nils Schröter, Ahmed Othman, Andrea Dressing, Cornelius Weiller, Horst Urbach, Marco Reisert, Sergiu Groppa, Jonas Hosp. „Inflammation-triggered enlargement of choroid plexus in subacute COVID-19 patients with neurological symptoms“. Annals of Neurology (2024) – in press.
Alexander Rau*, Nils Schröter*, Ganna Blazhenets, Andrea Dressing, Lea I Walter, Elias Kellner, Hansjörg Mast, Dirk Wagner, Horst Urbach, Cornelius Weiller, Philipp T Meyer, Marco Reisert* und Jonas A Hosp*. „Widespread white matter oedema in subacute COVID-19 patients with neurological symptoms“. Brain (2022) 145, Nr. 9: 3203–13. doi.org/10.1093/brain/awac045.
Hosp, Jonas A.*, Andrea Dressing*, Ganna Blazhenets, Tobias Bormann, Alexander Rau, Marius Schwabenland, Johannes Thurow, Dirk Wagner, Cornelius Waller, Wolf D Niesen, Lars Frings, Horst Urbach, Marco Prinz, Cornelius Weiller, Nils Schröter*, und Philipp T Meyer*. „Cognitive impairment and altered cerebral glucose metabolism in the subacute stage of COVID-19“. Brain (2021)144, Nr. 4: 1263–76. doi.org/10.1093/brain/awab009.